
下列离子方程式中,正确的是( )
A. 氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O
B. 铁片投入稀硝酸中:Fe+2H+=Fe2++H2↑
C. 氯化铁溶液与铜反应:2Fe3++Cu=2Fe2++Cu2+
D. 向氯化铁溶液加入铁粉:Fe3++Fe=2Fe2+
科目:高中化学 来源:2016-2017学年河南省漯河市高二3月月考化学试卷(解析版) 题型:选择题
下列各组有机物中,不论二者以何种比例混合,只要总物质的量一定,完全燃烧时消耗的氧气为一恒量的是
A. C3H6、C3H8 B. C4H6、C3H8 C. C8H10、C6H6 D. C8H16、C10H8
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二下学期月考(一)化学试卷(解析版) 题型:选择题
下列说法错误的是
A 冰中既存在范德华力,又存在氢键
B.简单立方是非密置层三维堆积形成的, 面心立方是由密置层三维堆积形成的
C.所有共价键都有方向性, 形成氢键的三个相关原子可以不在条直线上
D.金属晶体的导电、导热性都与自由电子有关, 离子晶体在一定条件下可以导电
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:简答题
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
A | |||||||||||||
B | C | D | |||||||||||
E | F | G |
(1)画出C的原子结构示意图:_________________。
(2)E在元素周期表中的位置是_________________。
(3)B、C、D、F四种元素所形成的气态氢化物最稳定的是_____________(填化学式)。
(4)E、F、G元素的最高价氧化物对应水化物的酸性最强的是_____________(填化学式)。
(5)A、B、G三元素形成的化合物的电子式是________________,其中所含的化学键有哪些类型________________。
(6)B的最高价氧化物的水化物的稀溶液与金属铜反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
下列事实不能说明非金属性Cl﹥I的是( )
A. KClO3+I2=KIO3+Cl2 B. Cl2+2I-=2Cl-+I2
C. 酸性:HClO4﹥HIO4 D. 氧化性:Cl2﹥I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
已知某粒子AzRn+,则元素R原子的电子数为( )
A. Z B. A-Z C. A-Z+n D. A-Z-n
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:选择题
常温下,某溶液X由Fe3+、SO42-、Cu2+、Na+、CO32-、Al3+中的几种离子组成。取少量待测液滴加KSCN溶液,溶液变红;另取少量待测滴加NaOH溶液至pH=4后过滤,向滤液中继续滴加NaOH溶液至过量时又得到沉淀W和溶液Y。可能用到的数据如下表所示,下列说法正确的是
沉淀物 | Fe(OH)3 | Cu(OH)2 | Al(OH)3 |
开始沉淀的pH | 1.9 | 4.7 | 3.4 |
沉淀完全的pH | 3.2 | 6.7 | 4.7 |
A. 该温度下Ksp[Fe(OH)3]=1×10-14.6
B. W主要含有 Cu(OH)2和Al(OH)3
C. 溶液X中一定含有Cu2+、Fe3+和SO42-
D. 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列实验设计可行的是( )
A. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
B. 加盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
C. 用萃取的方法分离汽油和煤油
D. 用溶解、过滤的方法分离KNO3和NaCl固体混合物
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三实验班第六次月考理综化学试卷(解析版) 题型:填空题
工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
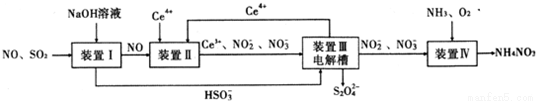
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示
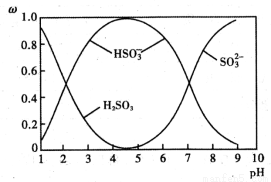
①下列说法正确的是 (填标号)。
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ 的作用之一是再生Ce4+ ,其原理如下图所示。
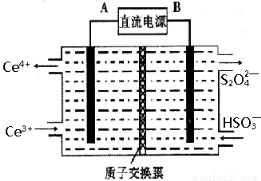
图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4) 已知进入装置Ⅳ的溶液中NO-2的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com