
| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 一定条件下,将1 mol N2与3 mol H2充入密闭容器中充分反应可生成2 mol NH3 | |
| C. | 充电电池的化学反应原理是氧化还原反应 | |
| D. | Na2O和Na2O2晶体中阳离子与阴离子个数比均为2:1 |
分析 A.共价化合物仅含有共价键,离子化合物可含有共价键,一定含有离子键;
B.根据可逆反应的特点判断;
C.电池将化学能转变为电子,存在电子的转移;
D.Na2O由钠离子与氧离子构成、Na2O2由钠离子与过氧根离子构成.
解答 解:A.共价化合物仅含有共价键,离子化合物可含有共价键,一定含有离子键,为NaOH,含有离子键和共价键,为离子化合物,故A正确;
B.氮气和氢气的反应为可逆反应,不能完全反应,故B错误;
C.电池将化学能转变为电子,存在电子的转移,一定为氧化还原反应,故C正确;
D.Na2O由钠离子与氧离子构成、Na2O2由钠离子与过氧根离子构成,阴阳离子的个数比都是1:2,故Na2O和Na2O2晶体中阳离子与阴离子个数比均为2:1,故D正确.
故选B.
点评 本题考查较为综合,涉及化学键、可逆反应、化学能与电能的转化以及离子化合物等知识,为高考常见题型,侧重于学生的分析能力的考查,注意相关知识的积累,难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
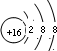 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为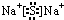 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+=H2O | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的结构式:O=C=O | |
| B. | S2-的结构示意图: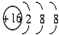 | |
| C. | R2+离子核外有a个电子,b个中子,R原子符号为:${\;}_{a+2}^{a+b+2}$R | |
| D. | 次氯酸的电子式: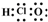 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com