
【题目】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
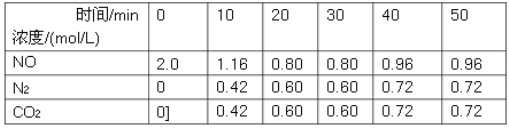
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(N2)=________mol/(Lmin);计算该反应的平衡常数K=___________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是________(填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率________(填“升高”或“降低”),ΔH________0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1=-49.1kJ/mol
CH3OH(g)+H2O(g)△H1=-49.1kJ/mol
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g)△H2=-24.5kJ/mol
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式__________________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:__________________
【答案】
(1)①0.03;0.56;②BC;③降低;<;
(2)CO2(g)+3H2(g) ![]() CH3OCH3(g)+3H2O(g) △H=-122.7 kJ/mol;
CH3OCH3(g)+3H2O(g) △H=-122.7 kJ/mol;
(3)CH3OCH3-12e-+16OH-=2CO32-+11H2O。
【解析】
试题分析:(1)①0~20min内,CO2的平均反应速率v(N2)=![]() =0.03molL-1min-1;C(s)+2NO(g)N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K=
=0.03molL-1min-1;C(s)+2NO(g)N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K=![]() =
=![]() =0.56;故答案为:0.03;0.56;
=0.56;故答案为:0.03;0.56;
②30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)N2(g)+CO2(g),依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算K=![]() =
=![]() =0.56,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;A.加入合适的催化剂,催化剂只改变化学反应速率,不改变化学平衡,故A错误;B.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故B正确;C.通入一定量的NO,新平衡状态下物质平衡浓度增大,故C正确;D.加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故D错误;故答案为:BC;
=0.56,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;A.加入合适的催化剂,催化剂只改变化学反应速率,不改变化学平衡,故A错误;B.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故B正确;C.通入一定量的NO,新平衡状态下物质平衡浓度增大,故C正确;D.加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故D错误;故答案为:BC;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为5:3:3,氮气和二氧化碳难度之比始终为1:1,所以5:3>4:3,说明平衡向逆反应方向移动,达到新平衡时NO的转化率,说明逆反应是吸热反应,则正反应是放热反应;故答案为:降低;<;
(2)已知:①CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H1=-49.1kJ/mol,②2CH3OH(g)
CH3OH(g)+H2O(g)△H1=-49.1kJ/mol,②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ/mol,根据盖斯定律,将①×2+②得,CO2(g)+3H2(g)
CH3OCH3(g)+H2O(g) △H2=-24.5kJ/mol,根据盖斯定律,将①×2+②得,CO2(g)+3H2(g) ![]() CH3OCH3(g)+3H2O(g) △H=(-49.1kJ/mol)×2+(-24.5kJ/mol)=-122.7 kJ/mol,故答案为:CO2(g)+3H2(g)
CH3OCH3(g)+3H2O(g) △H=(-49.1kJ/mol)×2+(-24.5kJ/mol)=-122.7 kJ/mol,故答案为:CO2(g)+3H2(g) ![]() CH3
CH3
(3)二甲醚氧气电池(电解质为KOH溶液)中负极二甲醚失去电子生成碳酸根离子和水,电极反应式为CH3OCH3-12e-+16OH-=2CO32-+11H2O,故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
A.Zn为电池的正极
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.该电池放电过程中电解质溶液浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长征2号火箭承担运载“神六”的使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是
A. LiH、LiD、LiT的摩尔质量之比为1∶2∶3 B. 它们都是强还原剂
C. H、D、T之间互称为同素异形体 D. 它们都是强氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化中,碳原子间的连接形成未发生改变的是
A. 丙酮与HCN发生加成反应
B. 1,3-丁二烯生成聚1,3-丁二烯
C. 乙二醇与重铬酸钾溶液共热被氧化为乙二酸(HOOC-COOH)
D. 乙苯与酸性高锰酸钾溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”对化学反应提出了“原子经济性”(原子节约) 的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型一定符合这一要求的是
①取代反应 ②加成反应 ③水解反应 ④加聚反应 ⑤酯化反应
A. ②④ B. ②③ C. ④⑤ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种重要的化工原料,温度在350℃以上容易分解。
(1)利用反应Ca(s)+O2![]() CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下:
CaO2(s),在纯氧条件下,制取CaO2的装置示意图如下:
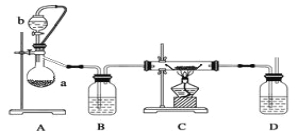
请回答下列问题:
(1)装置A中反应的化学方程式为 ;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是 。
仪器安装后应进行的实验操作:A通入氧气 B检查装置气密性 C加入药品 D停止通氧气 e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,正确的操作顺序为 。
(2)利用反应Ca2++H2O2+2NH3·H2O+6H2O=CaO2·8H2O+2NH4+,在碱性环境中,制取CaO2的流程示意图如下:
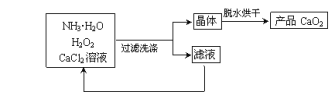
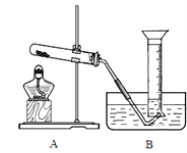
请回答下列问题:
①反应中,NH3·H2O在Ca2+和H2O2的反应历程中所起的作用是_____________ _;洗涤CaO2·8H2O晶体时,判断晶体是否完全洗净的试剂为 ;滤液循环使用时需在反应器中加入一种物质,该物质的化学式为 。
②利用反应2CaO2==2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图如右:若直接读数确定25℃、1大气压下气体的体积,则测量结果__________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26 kg青绿色液体,专家认定是2000多年前的“西汉美酒”。这是我国考古界、酿酒界的一个重大发现。
(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究。
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿。
实验步骤:
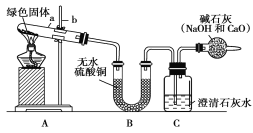
①对试管内的绿色固体进行加热,至完全分解。观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸。观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
④实验结论:绿色固体物质中含有________、________、________、________等元素(用元素符号作答)。(提示:装置内的空气因素忽略不计)
(2)表达与交流
①上述实验步骤③中发生反应的离子方程式________________________。
②干燥管中的碱石灰作用是什么? _。
若反应结束后,如果先移去酒精灯,可能出现的现象是什么? _。
③如果将B、C两装置对调行吗?________。为什么? _____ _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下为无色液体,而且密度大于水的是( )
① 苯 ② 硝基苯 ③ 溴苯 ④ 四氯化碳 ⑤溴乙烷 ⑥ 乙酸乙酯
A. ①⑥ B. ②③④⑥ C. ②③④⑤ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.所有反应的反应热都可以由实验直接测定
B.任何化学反应都需要用活化能来引发
C.200C、101KPa时,1g氢气与碘蒸气作用生成HI气体,放出7.45kJ热量,则此过程的热化学方程式可表示为:![]()
D.物质发生化学变化都伴随着能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com