
| A. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积,其比值一定为2:1 | |
| B. | 将NaOH溶液和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的二分之一 | |
| C. | 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍 | |
| D. | 制取TiO2可用TiCl4加大量水,同时加热:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl,所得的TiO2•H2O经焙烧得TiO2 |
分析 A.滴定管最大数值下面还有溶液,其体积未知;
B.对弱电解质,稀释促进电离;
C.盐酸是强酸,完全电离;醋酸是弱酸,部分电离;
D.TiCl4水解生成TiO2•xH2O.
解答 解:A.滴定管最大值下面还有溶液,且这部分溶液的体积未知,导致无法计算其溶液体积的比值,故A错误;
B.因氨水是弱电解质,在稀释过程中还要继续电离,故氨水中的c(OH-)比原来的一半还要大一些,故B错误;
C.因醋酸是弱酸,盐酸中的c(H+)远远超过醋酸中c(H+)的两倍,故C错误;
D.TiCl4水解生成TiO2•xH2O,所得的TiO2•H2O经焙烧得TiO2,故D正确.
故选D.
点评 本题考查弱电解质在水溶液中的电离平衡、盐类的水解等,难度不大,注意对弱电解质,稀释促进电离.


科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:简答题
已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是(填元素符号),D元素的原子核外有种不同运动状态的电子;有种不同能级的电子。基态的F3+核外电子排布式是。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是。
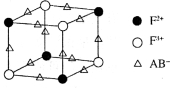
(5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的1/8(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为。
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2—NH2)形成配离子:
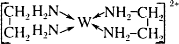
该配离子中含有的化学键类型有。(填字母)
a.配位键
B.极性键
C.离子键
D.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2—NH2)中C原子的杂化方式为。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
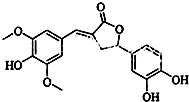
| A. | 分子中含有三种含氧官能团 | |
| B. | 1 mol 该化合物最多能与5mol NaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 能与FeCl3发生显色反应,不能和NaHCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
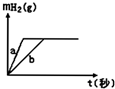
| A. | 曲线a为K,b为Na | B. | 投入的Na的质量大于K的质量 | ||
| C. | 投入的Na、K一定等质量 | D. | 稀盐酸的量一定是不足量的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
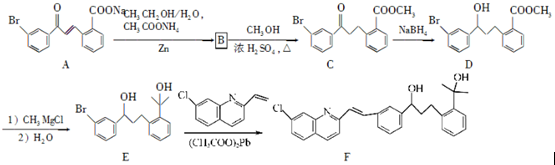 请回答下列问题:
请回答下列问题: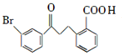 .
.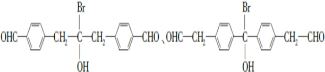 .
.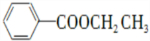 为原料制备
为原料制备 的合成路线流程图(乙醚溶剂及无机试剂任用)
的合成路线流程图(乙醚溶剂及无机试剂任用)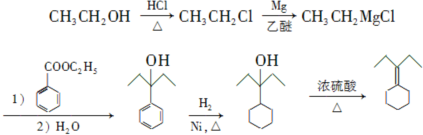 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 OH-+H3PO4
OH-+H3PO4 CH3COO-+NH4+.
CH3COO-+NH4+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | Cl2既是氧化产物又是还原产物 | |
| D. | 0.1mol KClO3 参加反应时有1mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
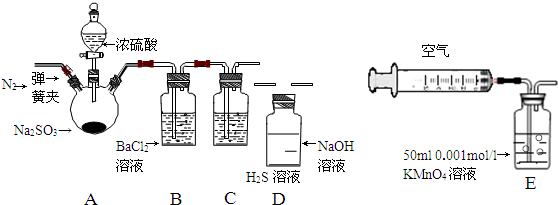
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙炔制氯乙烯;甲烷与氯气在光照条件下反应 | |
| B. | 溴乙烷和氢氧化钠乙醇溶液共热;乙醇制得乙烯 | |
| C. | 乙烯使溴的四氯化碳溶液褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 溴乙烷和氢氧化钠溶液共热;乙烯和氢气反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com