
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3
C.X2YZ2 D.XYZ3
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.汽油、柴油和植物油都是碳氢化合物
B.乙醇可以被氧化为乙酸,二者都能发生酯化反应
C.甲烷、乙烯和苯在工业上都可通过石油分馏得到
D.含5个碳原子的有机物,每个分子中最多可形成4个C—C单键
查看答案和解析>>
科目:高中化学 来源: 题型:
我国稀土资源丰富。下列有关稀土元素 62Sm与
62Sm与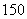 62Sm的说法正确的是( )
62Sm的说法正确的是( )
A. 62Sm与
62Sm与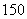 62Sm互为同位素
62Sm互为同位素
B. 62Sm与
62Sm与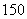 62Sm的质量数相同
62Sm的质量数相同
C. 62Sm与
62Sm与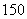 62Sm是同一种核素
62Sm是同一种核素
D. 62Sm与
62Sm与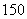 62Sm的核外电子数和中子数均为62
62Sm的核外电子数和中子数均为62
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是溶于水显碱性的四原子分子;c与f作用可生成2个中性分子g。
试写出:
(1)a微粒的原子结构示意图为____________。
(2)b和e相应元素的最高价氧化物的水化物的碱性强弱比较为:________>________(用化学式表示)。
(3)d的水溶液显碱性的原因(用电离方程式表示)__________________。
(4)c微粒是________,f微粒是________(用化学式表示)。
(5)b相应的元素的单质与g微粒反应的化学方程式为
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于第三周期从左到右的主族元素,下列说法中不正确的是( )
A.原子半径逐渐减小
B.电子层数逐渐增多
C.最高正化合价逐渐增大
D.元素的电负性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.石油的分馏是汽油的唯一来源
B.若改用柴油作为汽车的燃料,可减少汽车尾气对大气的污染
C.石油的唯一用途是做燃料
D.目前石油裂解已成为生产乙烯的主要方法
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如下图所示,试回答下列问题。
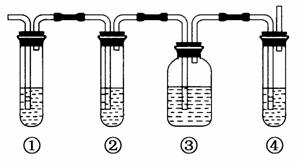
(1)图中①、②、③、④装置可盛放的试剂是
①________;②________;③________;④________。
(将下列有关试剂的序号填入空格内)
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是________________________________________________________________________。
(3)使用装置②的目的是________________________________________________________________________。
使用装置③的目的是________________________________________________________________________。
(4)能说明含有乙烯的现象是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ge4++Fe2+===Fe3++Ge3+,Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ge3+ B.Sn2+、Ge3+、Fe2+
C.Ge3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ge3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com