
| A. | 化学反应速率v | B. | 化学平衡常数K | ||
| C. | 弱电解质的电离平衡常数K | D. | 水的离子积常数Kw |
分析 A.升高温度,化学反应速率一定增大;
B.化学平衡常数随温度变化而变化,对于放热的化学反应,升高温度K减小;
C.弱电解质的电离为吸热的,升高温度,促进电离;
D.水的电离为吸热的,升高温度促进水的电离;
解答 解:A.升高温度,活化分子碰撞的几率增大,则化学反应速率一定增大,故A不选;
B.对于放热的化学反应,升高温度K减小,即升高温度,化学反应的平衡常数K不一定增大,故B选;
C.弱电解质的电离为吸热的,升高温度,促进电离,则升高温度,弱电解质的电离平衡常数K增大,故C不选;
D.水的电离为吸热的,升高温度,促进电离,则升高温度,水的离子积常数KW增大,故D不选;
故选B.
点评 本题考查温度对反应速率、平衡常数、溶解度、弱电解质电离的影响,明确化学反应中吸热与放热反应受温度影响导致的平衡移动是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应的氧化剂是ClO- | |
| B. | 反应生成l mol氧化产物时,转移的电子为6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物质能的缺点是严重污染环境 | |
| B. | 生物质能源是可再生的能源 | |
| C. | 利用生物质能就是间接利用太阳能 | |
| D. | 使用沼气这种生物质能是对化学能的充分利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)?M2R4(g),加入1mol M2和2molR2,反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )
在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)?M2R4(g),加入1mol M2和2molR2,反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( )| A. | M2既可能为固体,也可能为气体 | |
| B. | 达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2,则R2转化率不变 | |
| C. | 达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍 | |
| D. | 若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4,则新的平衡时气体的平均相对分子质量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和时所需NaOH的量 | B. | 与Mg反应的起始速率 | ||
| C. | OH-的物质的量浓度 | D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将容器压缩时,正逆反应速率均不变 | |
| B. | 5 min内平均反应速率v(X)=0.02 mol/(L•min) | |
| C. | 向平衡后的体系中加入l molM(s),平衡向逆反应方向移动 | |
| D. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
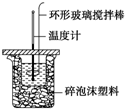 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:4 | B. | 1:1:1 | C. | 2:1:2 | D. | 1:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com