
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | Cl2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | NO2 | SO2 | BaCl2 |
| A. | ①②③④⑤ | B. | 只有②③④ | C. | 只有①③④ | D. | ①②③④⑥ |
分析 ①石灰水过量,甲和乙两种气体均为酸性氧化物,反应生成碳酸钙、亚硫酸钙沉淀;
②石灰水过量,乙为酸性氧化物,反应生成碳酸钙沉淀;
③硝酸的酸性大于碳酸,但酸性条件下二氧化硫与硝酸钡发生氧化还原反应生成硫酸钡沉淀;
④氯气与二氧化硫发生氧化还原反应生成硫酸,再与氯化钡反应生成硫酸钡沉淀;
⑤二氧化碳、氨气反应生成碳酸铵,与氯化钙反应生成碳酸钙沉淀和氯化铵,但二氧化碳过量不生成沉淀;
⑥二氧化氮、二氧化硫发生氧化还原反应生成硫酸,再与氯化钡反应生成硫酸钡沉淀.
解答 解:①石灰水过量,甲和乙两种气体均为酸性氧化物,反应生成碳酸钙、亚硫酸钙沉淀,一定有沉淀生成,故选;
②石灰水过量,乙为酸性氧化物,反应生成碳酸钙沉淀,一定有沉淀生成,故选;
③硝酸的酸性大于碳酸,但酸性条件下二氧化硫与硝酸钡发生氧化还原反应生成硫酸钡沉淀,则有沉淀生成,故选;
④氯气与二氧化硫发生氧化还原反应生成硫酸,再与氯化钡反应生成硫酸钡沉淀,则有沉淀生成,故选;
⑤二氧化碳过量时与氨气反应生成碳酸氢铵,与氯化钙不反应,不生成沉淀,故不选;
⑥二氧化氮、二氧化硫发生氧化还原反应生成硫酸,再与氯化钡反应生成硫酸钡沉淀,则有沉淀生成,故选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断及与量有关的反应,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:解答题
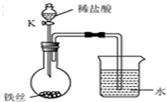 水是最普通、最常见的物质之一.
水是最普通、最常见的物质之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO>H2SO4>H2CO3; 非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF | |
| D. | 离子半径:Na+>Mg2+>Al3+>Cl-; 原子半径:Na>Mg>Al>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
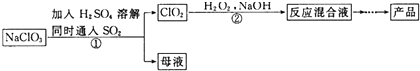
| A. | CO2是氧化产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1mol KClO3参加反应,转移的电子为1mol | |
| D. | H2C2O4的氧化性强于ClO2的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 80% | C. | 78.4% | D. | 21.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com