
科目:高中化学 来源:2015-2016学年河北省高一上学期12月月考化学试卷(解析版) 题型:填空题
下图表示的是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。
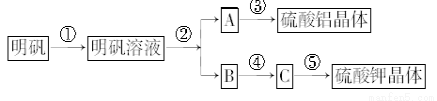
进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是 ,
其反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届广东省七校联合体高三上学期第二次联考理综化学试卷(解析版) 题型:实验题
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr  NaHSO4+HBr↑,CH3CH2OH+HBr
NaHSO4+HBr↑,CH3CH2OH+HBr CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm-3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
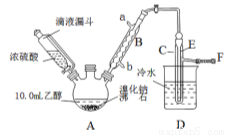
(1)A装置的名称是 。
(2)实验中用滴液漏斗代替分液漏斗的优点为 。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式 。
(4)给A加热的目的是 ,F接橡皮管导入稀NaOH溶液,其目的主要是 。
(5)图中C中的导管E的末端须在水面以下,其目的是 。
(6)为了除去产品中的主要杂质,最好选择下列__(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。
①在上述提纯过程中每次分液时产品均从分液漏斗的_____________(上口或下口)取得。
②从乙醇的角度考虑,本实验所得溴乙烷的产率是______________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期质检化学试卷(解析版) 题型:填空题
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料.
已知:H2(g)+ O2(g)═H2O(g)△H1=﹣241.8kJ•mol﹣1
O2(g)═H2O(g)△H1=﹣241.8kJ•mol﹣1
C(s)+ O2(g)═CO(g)△H2=﹣110.5kJ•mol﹣1
O2(g)═CO(g)△H2=﹣110.5kJ•mol﹣1
则焦炭与水蒸气反应生成CO的热化学方程式为: .
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难.如果在实验室,你处理金属钠着火的方法是 .
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染.处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 .
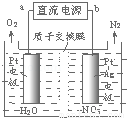
(4)电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3﹣+4H+═5O2↑+2N2↑+2H2O,则阴极反应式为 .
(5)欲降低废水中重金属元素铬的毒性,可将Cr2O72﹣转化为Cr(OH)3沉淀除去,
已知在常温下:Ksp[Fe(OH)2]=1×10﹣15、Ksp[Fe(OH)3]=1×10﹣38、Ksp[Cr(OH)3]=1×10﹣23,当离子浓度在1×10﹣5mol/L以下时认为该离子已经完全沉淀,请回答:
①相同温度下Fe(OH)3的溶解度 Cr(OH)3的溶解度(填“>”、“<”或“=”)
②浓度为0.1mol/L的Fe2+与10.0mol/L Cr3+同时生成沉淀的pH范围是 .
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上第二次阶段测化学试卷(解析版) 题型:选择题
下列物质转化在给定条件下能实现的是
A.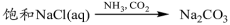
B.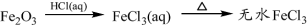
C.Al2O3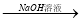 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3
D.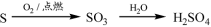
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中一定正确的是
A.溶质的质量分数为w=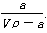 ×100%
×100%
B.溶质的物质的量浓度c=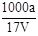 mol·L-1
mol·L-1
C.溶液中c(OH-)=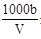 mol·L-1
mol·L-1
D.上述溶液中再加入VmL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省沈阳市四校协作体高三上学期期中联考化学试卷(解析版) 题型:选择题
某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:

则下列说法正确的是
A.气体甲、沉淀甲一定为纯净物
B.CO32-、Al3+、K+一定不存在
C.SO42-、NH4+一定存在,NO3-、Cl–可能不存在
D.若含有Fe3+,则一定含有Cl-
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第三次月考化学试卷(解析版) 题型:选择题
有硫酸、硫酸亚铁、硫酸铁的混合液200mL、已知溶液中各阳离子的物质的量浓度相等,硫酸根离子的浓度为3.0 mol·L-1,则该溶液理论上可溶解铁粉的质量为
A.5.6g B.11.2g C.14.Og D.16.8g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附属中学高二上二次阶段测化学卷(解析版) 题型:填空题
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是_____________。
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
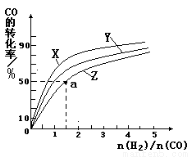
①在上述三种温度中,曲线Z对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)  CH3OH(g)的平衡常数 K= 。
CH3OH(g)的平衡常数 K= 。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com