
分析 (1)尿素的化学式中含有2个N原子,据此计算出2mol尿素含有N、O原子的物质的量,再根据N=nNA计算出含有H原子数;结合水分子的组成计算出需要水的物质的量及质量;
(2)根据n=$\frac{m}{M}$计算出铵根离子的物质的量,然后结合铵根离子中含有10个电子计算出含有电子的物质的量;
(3)结合硫酸铝的化学式组成计算出含有硫酸根离子的物质的量.
解答 解:(1)2mol尿素[CO(NH2)2]中含N的物质的量为:2mol×2=4mol;含有H的数目为:0.2mol×4×NAmol-1=8NA;2mol尿素[CO(NH2)2]中含O的物质的量为2mol,氧原子数相同时氧原子的物质的量相等,则需要水的物质的量为:$\frac{2mol}{1}$=2mol,质量为:18g/mol×2mol=36g,
故答案为:4;8NA;36;
(2)3.6g NH4+的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,含电子的物质的量为:0.2mol×10=2.0mol,
故答案为:2.0;
(3)含0.4mol Al2(SO4)3的溶液中,含SO42-的物质的量为:n(SO42-)=3n[Al2(SO4)3]=0.4mol×3=1.2mol,
故答案为:1.2.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量等之间的关系为解答关键,试题有利于提高学生的分析能力及化学计算能力.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
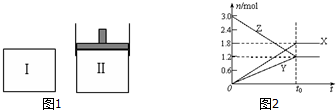
| A. | 该反应的化学方程式为:3X+2Y?2Z | |
| B. | 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 | |
| C. | 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 | |
| D. | 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
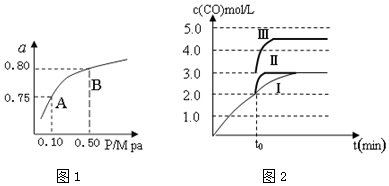
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
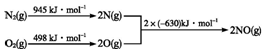
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测量中和热时不能用金属棒搅拌混合溶液 | |
| B. | 中和热不是一个定值,其大小由中和反应所消耗的酸和碱的多少决定 | |
| C. | 50mL0.5mol/LHCl和50mL0.55mol/LNaOH溶液反应测定中和热,计算式为△H=$\frac{4.18×100}{0.025}$×△tKJ/mol (注:△t-温度平均变化量) | |
| D. | 为了减少误差,量取稀NaOH溶液后,立即用同一个量筒量取稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 用苯萃取碘水中碘后,静置后取出有机层 | 先从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,再继续从分液漏斗下端管口放出上层液体 |
| B | 配制500mL2mol/L的氯化铵溶液 | 用托盘天平称取53.5g氯化铵晶体放入500mL容量瓶,加少量水,振荡后再加水至刻度线 |
| C | 测定氯水的pH | 用玻璃棒蘸取少量溶液滴于pH试纸中央,片刻后与标准比色卡对照 |
| D | 用标准盐酸滴定未知浓度的NaOH溶液(含酚酞) | 左手控制酸式滴定管活塞使液体滴下,右手不断振荡锥形瓶,眼睛要始终观察锥形瓶中溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com