
| A. | 在25℃、1.01×105Pa时,11.2L氮气所含的原子数目为NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有的离子总数为0.3NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 1molP4和1molCH4中含有的共价健数均为4NA |
分析 A、在25℃、1.01×105Pa时,气体摩尔体积大于22.4L/mol;
B、碳酸根在溶液中水解,导致离子个数增多;
C、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
D、白磷中含6条共价键,而甲烷中含4条共价键.
解答 解:A、在25℃、1.01×105Pa时,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,含有的原子个数小于NA个,故A错误;
B、碳酸根在溶液中水解,导致离子个数增多,且水也能电离出氢离子和氢氧根,故此溶液中含有的离子总数大于0.3NA个,故B错误;
C、23g钠的物质的量为1mol,而钠反应后变为+1价,故1mol钠反应转移NA个电子,故C正确;
D、白磷中含6条共价键,而甲烷中含4条共价键,故1mol白磷和1mol甲烷中分别含6NA个和4NA个共价键,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X为IA族时,Y不可能是第三周期VIA族元素 | |
| B. | 由X、Y、Z、W四种元素不可能形成其原子个数比为1:3:1:1的化合物 | |
| C. | Z元素的原子半径一定小于W元素的原子半径 | |
| D. | 若X为IVA族元素时,X、Y两元素可形成含有共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:MH+OH--e-═M+H2O | |
| B. | 放电时,每转移1mol电子,有1mol NiOOH被氧化 | |
| C. | 充电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电池电解液可用KOH溶液,充电过程中KOH浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )可用于制造利胆药.下列有关对羟基苯乙酮的说法错误的是( )
)可用于制造利胆药.下列有关对羟基苯乙酮的说法错误的是( )| A. | 分于式为C8H8O2 | |
| B. | 分子中的碳、氧原子可能都处于同一平面 | |
| C. | 能与氢气发生加成反应 | |
| D. | 含有苯环的羧酸类同分异构体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
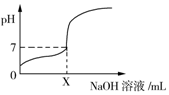 常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )| A. | X=20 | |
| B. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{{c({A^-})}}$的值减小 | |
| C. | 0.1 mol/L的NaOH溶液中,由水电离出的c(OH-)=0.1 mol/L | |
| D. | 加入NaOH溶液体积为X mL时,溶液中c(A-)=0.05 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com