


科目:高中化学 来源:不详 题型:单选题
| A.1L 0.1 mol·L—1的CH3COONa溶液中CH3COO—的总数是0.1NA |
| B.常温常压下,1.6g O2和O3混合气体中质子总数为0.8 NA |
| C.一定条件下,2mol SO2和 1mol O2发生反应,转移的电子总数一定是4NA |
| D.1L 0.1mol·L—1的葡萄糖溶液中分子总数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
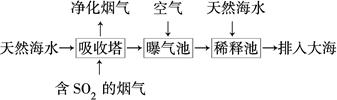
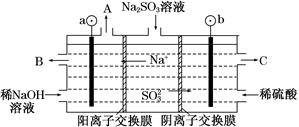
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CO2的比例模型 |
| B.氢化铵的电子式:[H∶N?,?H,H ∶H]+H- |
| C.CH3—CH—CH—CH—CH2CH3CH3C2H5CH3的名称:2,3二甲基4乙基己烷 |
| D.二氧化硅的分子式SiO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CO2的电子式: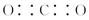 |
B.质子数为43、中子数为56的Tc原子: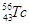 |
C.Cl-的结构示意图: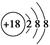 |
D.氨基乙酸的结构简式: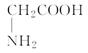 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上利用N2和H2合成氨,实现人工固氮 |
| B.实验室用NH4Cl和Ca(OH)2制备NH3 |
| C.用FeCl3溶液作为“腐蚀液”刻蚀电路铜板 |
| D.用Na2O2作潜水艇的供氧剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.①③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
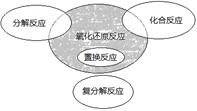
| A.4NH3 +5O2 =4NO+6 H2O |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl +Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com