
【题目】(1) ______mol CO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)0.4 mol SiH4分子中所含原子数与________g HCl分子中所含原子数相等。
(3)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为____________;一氧化碳的质量为___________。
(4)等物质的量O2和臭氧(O3),其质量之比为______________。若O2和O3质量相等,则其原子数之比为_____________。
(5)含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl-1.5 mol,K+和Na+共1.5 mol,Mg2+为0.5 mol,则SO42-的质量为________________。
【答案】1.536.56.72L2.8g2︰31︰148
【解析】
(1)1.806×1024个H2O分子的物质的量为![]() =3mol,与之含有相等O原子数目的二氧化碳的物质的量为3mol÷2=1.5mol,故答案为:1.5;
=3mol,与之含有相等O原子数目的二氧化碳的物质的量为3mol÷2=1.5mol,故答案为:1.5;
(2)0.4 mol SiH4分子中所含原子数为0.4×5NA=2NA,则含有相同原子数的HCl的物质的量为1mol,其质量为:1mol×36.5g/mol=36.5g,故答案为:36.5g;
(3)设 CH4为 x mol, CO为 y mol,则 x +y==8.96/22.4==0.4 mol ;16x+28y==7.6解得x=0.3 ,y=0.1即 CH4 为 0.3 mol,CO 为0.1 mol,则甲烷体积为 0.3mol×22.4L/mol=6.72 L,
CO 质量0.1mol×28g/mol=2.8 g,故答案为:6.72L、2.8g;
(4)等物质的量的O2和O3质量之比等于其摩尔质量之比,为32:48=2:3;O2和O3都由相同氧原子构成,二者质量相等,则含有氧原子数相等,即含有氧原子数目之比为1:1,故答案为:2︰3、1︰1;
(5)溶液呈电中性,由电荷守恒可知:n(Cl-)+2n(SO42-)=n(K+)+n(Na+)+2n(Mg2+),
即:1.5mol+2n(SO42-)=1.5mol+2×0.5mol,解得n(SO42-)=0.5mol,其质量为:0.5mol×96g/mol=48g,故答案为:48g。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 1L0.1mol·L-1CH3COOH溶液中含H+的数目为0.1NA
B. 标准状况下,2.24LCl2 溶于水,转移的电子数为0.1NA
C. 100g质量分数为46%的酒精溶液中含氧原子总数为4NA
D. 常温下,将1molFe加入足量硝酸中,生成H2的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
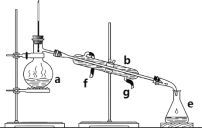
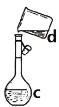
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为_______。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;容量瓶用蒸馏洗涤后残留有少量的水_____________;若定容时俯视刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)3.01×1023个HNO3的物质的量是_________
(2)HNO3的摩尔质量是____________________;94.5g HNO3的物质的量是_______________
(3)1.5NA个H2O中,H原子的物质的量是__________
(4)6.02×1023个H2SO4分子中H+的质量为___________
(5)9g NH4+中的原子数目是______________;电子数目是________________
(6)含a g Cu2+的CuCl2中Cl- 的个数___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,其气体密度是相同条件下H2的14倍,E是一种能使溴的四氯化碳溶液褪色的乙酸酯。A、B、C、D、E在一定条件下存在如下转化关系:
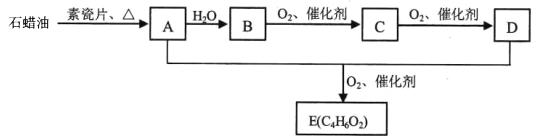
请回答:
(1)有机物C中含有的官能团名称是________ ;工业上,由石蜡油→ A的加工过程称为________。
(2)写 出 A+D+O2→ E的化学反应方程式________。
(3)下列说法不正确的是________。
A,75%(体积分数)的B溶液常用于医疗消毒
B.有机物E在 碱性条件下可发生皂化反应
C.有机物A能 与溴发生氧化反应使溴水褪色
D.用新制银氨溶液可鉴别有机物C、D、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取不同质量由 Ba(OH)2和 BaCO3组成的均匀混合样品,先加适量的水溶解,然后加入100mL某浓度稀盐酸,所得CO2气 体的体积(己换算为标准状况)与加入样品的质量关系如图所示(不考虑CO2的溶解、反应及碳酸氢盐的生成)。请计算:
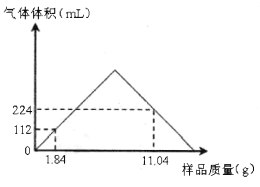
(1)混合物中Ba(OH)2和 BaCO3物质的量之比为________。
(2)稀盐酸物质的量浓度为________mo1/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01mol/LNaOH溶液滴定20.00mL0.01mol/LCH 3COOH溶液,所得滴定曲线如右图。下列说法正确的是
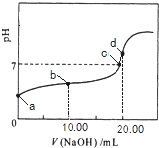
A. b点对应的溶液中: c(OH—)+c(CH3COO—) = c(Na+)+c(H+)
B. a点对应溶液的pH= 2
C. C点表示NaOH溶液与CH3COOH溶液恰好完全反应
D. d点对应的溶液中,水的电离程度小于同温下纯水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18 mol·L-1 浓硫酸配制90 mL 3.0 mol·L-1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积
②量取一定体积的浓硫酸
③溶解
④
⑤转移、洗涤
⑥定容、摇匀
⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是_____________,量取浓硫酸所用的量筒的规格是 _____________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。浓硫酸稀释的操作______________。
(2)第④步实验的操作是_______________________________________________________
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.用量筒量取浓硫酸后洗涤量筒并将洗涤液注入容量瓶内___________________;
B.容量瓶用蒸馏水洗涤后残留有少量的水________________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 X、Y、Z 三种元素,X 是有机化合物中必含的元素, Y 是地壳里含量最多的元素,Z 是质 量最轻的元素。X、Y、Z 三种元素组成的有机物 M 能被酸性高锰酸钾氧化生成 N。为了测定有机物 M 的结构,做如下实验:
①将 4.6 g 有机物 M 完全燃烧,测得生成 0.2mol CO2 和 5.4 g 水; ②用质谱仪检测有机物 M,得到如图 1 所示的质谱图; ③用核磁共振仪处理有机物 M,得到如图 2 所示图谱。

试回答下列问题:
(1)M 的结构简式是___________________,N 中含有的官能团的结构简式为_____________。
(2)写出 M 在铜作催化剂且加热条件下与氧气发生反应的化学方程式___________________。
(3)写出 M 与 N 在浓 H2SO4加热条件下发生反应的化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com