
(15分)
已知:(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:

4FeCl3+2NH2OH·HCl 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,价层电子排布式 。 ②羟胺(NH2OH)中N原子的杂化方式 。
③Fe2+与邻啡罗啉形成的配合物中,配位数为 。
(2)硫酸铜晶体的化学式也可以表达为Cu(H2O)4SO4·H2O晶体,该晶体中含有的化学键类型是
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等。 其中元素P、As、Se第一电离能由小到大的顺序为: 。
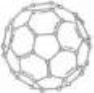

图1 图2
(4)① 有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1 mol C60分子中π键的数目为 ,C60的晶胞结构如图2,则其配位数为_______若此晶胞的密度为ρg/cm3则两个最近C60间的距离为________cm(列式表达,已知阿伏伽德罗常数为NA)
② 如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 。
(1)①3d6;② sp3;③ 6;(2)离子键 共价键(配位键)
(3)Se< As< P (4)① 30NA ;12 ; ② K 2C60
② K 2C60
【解析】
试题分析:(1)①Fe是26号元素,在Fe2+的核外有24个电子,在基态时,价层电子排布式3d6;②羟胺(NH2OH)中N原子的杂化方式sp3杂化; ③由化合物的结构简式可知:Fe2+与邻啡罗啉形成的配合物中,配位数为6;(2)在硫酸铜晶体Cu(H2O)4SO4·H2O中含有的化学键为离子键、共价键、配位键;(3)元素P、As是同一主族的元素,从上到下,原子半径增大,原子失去电子容易,所以第一电离能P>As;As、Se是同一周期的元素,原子半径As>Se,但是由于As原子的最外层的价电子处于该轨道的半充满的稳定状态,所以第一电离能As>Se.因此这三种元素的第一电离能由小到大的顺序为Se< As< P;(4)①在一个C60分子中含有60个C原子,每个C原子与连接的C原子形成了一个π键,而π键是两个原子所共有的,因此平均每个C原子含有的π键个数为1/2π键,。所以1 mol C60分子中π键的数目为60πNA÷2=30NA。由C60的晶胞结构示意图可知,它是立方面心结构,与每个C原子紧密连接的距离最近的C原子个数为(3÷8)÷2=12.即其配位数为12。每个晶胞中含有的C60分子个数是8×1/8+6×1/2=4;所以晶胞的边长 。根据晶胞示意图图可知两个最近C60间的距离为面对角线的一半,就是
。根据晶胞示意图图可知两个最近C60间的距离为面对角线的一半,就是 即为
即为 。②第四周期电负性最小的原子是K原子,由于每个顶点可形成1/4个四面体,一共有8个顶点,所以可形成2个正四面体。故可填充2个K原子,所形成的掺杂C60化合物的化学式为K 2C60。
。②第四周期电负性最小的原子是K原子,由于每个顶点可形成1/4个四面体,一共有8个顶点,所以可形成2个正四面体。故可填充2个K原子,所形成的掺杂C60化合物的化学式为K 2C60。
考点:考查原子价层电子排布式、原子杂化方式、离子的配位数、物质内的化学键、第一电离能的比较、晶胞中最近的微粒的距离及掺杂C60化合物的化学式的确定的知识。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:填空题
(7分)在研究化学反应中的能量变化时,我们通常做下面的实验:

在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
实验步骤 | 实验现象及结论 |
将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生 |
用手摸烧杯下部 | 感觉烧杯变凉说明此反应是_ ② 反应 |
用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有_③___生成 |
(1)写出题目中①②③填入的内容
① ② ③
(2)实验中要立即用玻璃棒迅速搅拌的原因是: __________________。(2分)
(3)在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?(2分)
___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
下列实验的的失败原因是因为缺少必要的实验步骤造成的是
①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
②实验室用无水乙醇和浓硫酸共热到140℃制乙烯
③验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液出现褐色沉淀
④做醛的还原性实验时,当加入新制的氢氧化铜悬浊液后,未出现红色沉淀
⑤检验淀粉是否水解时将淀粉与少量稀硫酸加热一段时间后,加入银氨溶液后未析出银镜
A.①④⑤ B.①③④⑤ C.③④⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
分析下表中各项的排布规律,有机物X是按此规律排布的第23项,下列有关X的组成、性质的说法中肯定错误的是
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
①是己酸②是己醇 ③是戊酸甲酯 ④在稀硫酸中易变质⑤一定能与钠反应
A.②⑤B.①③④
C.③④D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:选择题
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是
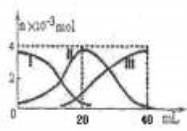
A.当V(NaOH)=40mL时,c (Na+)+ c(H+)=2 c(A2-)+c(OH-)
B.当V(NaOH)=20mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.滴加过程中当溶液呈中性时,V(NaOH)<20mL
D.HA-的电离程度小于水解程度
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
[化学――选修5:有机化学基础](15分)
添加塑化剂可改善白酒等饮料的口感,但不应超过规定的限量。DBP是一种酯类塑化剂,可由下列路线合成:
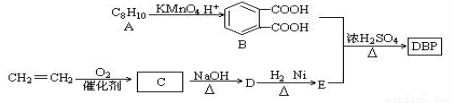
已知以下信息:
①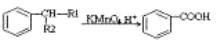
②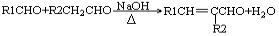 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式 ,D的结构简式是 ,D→E的反应类型 ;
(2)D和H2 1︰1反应生成E,则E官能团名称为_________,DBP的分子式为
(3)由B和E以物质的量比1︰2合成DBP的化学方程式: ;
(4)写出2种同时符合下列条件的B的同分异构体结构简式 ;
①能和NaHCO3溶液反应生成CO2 ③能使FeC13溶液发生显色反应
②能发生银镜反应 ④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的方程式 ,
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(16分)复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2。
(1)H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。
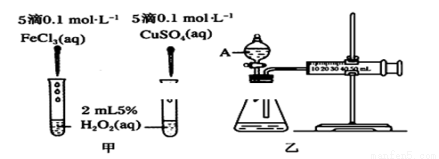
若利用甲实验,可通过观察________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________;若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
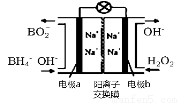
(2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作通信卫星电源。其工作原理如图所示,写出a极上的电极反应式: ,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
(3)锗(Ge)与碳是同主族元素,最新研究表明有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应,但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
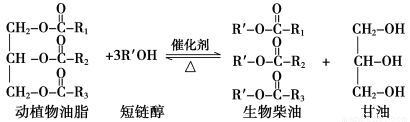
下列叙述错误的是
A.生物柴油由可再生资源制得
B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物
D.“地沟油”可用于制备生物柴油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com