
【题目】氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钦(TiO2)表面作用使海水分解得到氢气的新技术:![]() 。制得的氢气可用于燃料电池。试回答下列问题:
。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水光解产物应用于燃料电池的整个过程中完成了能量的转化:____能转变为____能,最后转化 为_______能。
(2)水分解时,断裂的化学键为_____键(填“共价”或“离子”),分解海水的反应属于____反应(填“放热”或“吸热”)。
(3)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2—4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的____极;电子从该极____(填“流入”或“流出”)。
(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。该原电池的负极材料是_____,正极反应式为______。
【答案】(1)太阳;化学;电;(2)共价;吸热;(3)负;流出;(4)Zn ;O2 +4H++4e-=2H2O。
【解析】
试题分析:(1)海水光解产物应用于燃料电池的整个过程中完成了能量的转化方式是光能转变为化学能,氢气用于制原电池,能量转化方式是化学能转化为电能;(2)水是共价化合物,水分解时,断裂的化学键为共价键;分解海水的反应是一种物质变为两种物质,氢气燃烧反应是放热反应,则水分解反应属于吸热反应;(3)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2—4e-=2H2O;B极:O2+4e-=2O2-,则A极失去电子,发生的是氧化反应,所以A电极是电池的负极;电子从该极流出,经外电路流向正极。(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。该原电池的负极材料是活动性较强的Zn,正极反应式为O2 +4H++4e-=2H2O。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】有5种物质:①乙烷;②乙烯;③乙醇;④苯;⑤聚乙烯。其中既不能使酸性KMnO4溶液褪色,也不能使溴的CCl4溶液褪色的是( )
A.①②③⑤B.③④C.①④⑤D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
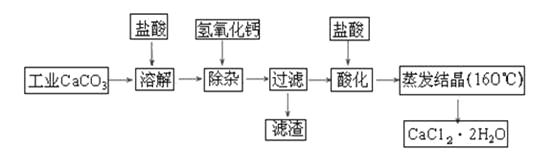
(1)除杂操作时加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:
①___________________________;②___________________________;
(3)测定样品中Cl-含量的方法是:
A.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;B.量取25.00 mL待测溶液于锥形瓶中;C.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中不需要用盛装溶液润洗的仪器有 ,若润洗后会导致结果
②计算上述样品中CaCl2·2H2O的质量分数为________________;
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。
(4)工业上冶炼金属钙的方法是 ;请写出此冶炼的化学反应方程式________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )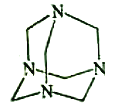
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极)。
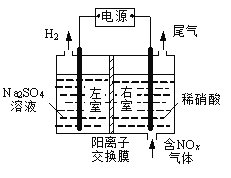
(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式: 。
②若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为 mol。
(2)某小组在右室装有10 L 0.2 mol/L硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2mol/L硝酸溶液,需量取 mL的密度为1.4 g/mL、质量分数为63%的浓硝酸。
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 molHNO3、0.1 molHNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有聚集诱导发光特性,在光电材料等领域应用前景广阔。以下是TPE的合成路线(部分试剂和反应条件省略):
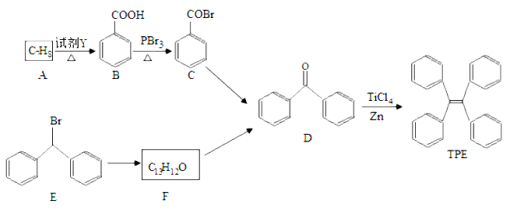
(1)A的名称是 ;试剂Y为 。
(2)B→C的反应类型是 ;B中官能团的名称是 ; D中官能团的名称 。
(3)E→F的化学方程式是 。
(4)W是D的同分异构体,具有下列结构特征:属于萘(![]() )的一元取代物;存在羟甲基(—
)的一元取代物;存在羟甲基(—
CH2OH)。写出W所有可能的结构简式: 。
(5)下列说法正确的是 ( )
a.B的酸性比碳酸强 b.D不能发生还原反应
c.E含有3种不同化学环境的氢 d.TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。
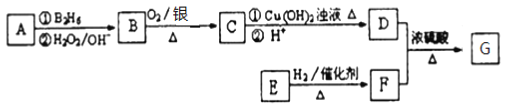
已知:(1) ![]()
(2) 有机物A属于烃类,其相对分子质量为56,核磁共振氢谱有2组峰
(3) E能发生银镜反应,1molE与2molH2可以发生反应生成F
(4)有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链
回答下面的问题:
(1)有机物B:____________,反应E→F的反应类型为:____________;
(2)E的结构简式为____________:
(3)A在一定条件下生成高分子化合物的化学方程式为____________;
(4)D+F→G 的化学方程式:____________;
(5)已知有机化合物甲符合下列条件:①芳香族化合物②与F互为同分异构体③能被催化氧化成醛。符合上述条件的有机物甲有____________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰的有机物的结构简式为(写出符合条件的其中一种即可)____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种处理污水的燃料电池模型如下图所示。该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙。下列叙述不正确的是
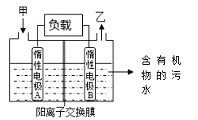
A. B电极为正极
B. 气体乙可能为CO2
C. O2在A电极得电子
D. 电池工作时,B电极附近的pH逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com