
【题目】下列属于电解质的是
A. 石墨 B. 一水合氨 C. 氯化钠溶液 D. 酒精
科目:高中化学 来源: 题型:
【题目】(下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
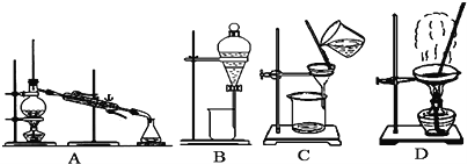
(1)写出图中标序号的对应仪器名称:②_________________,③_______________。仪器②中水流方向为___________(填“上进下出”或 “下进上出”)
(2)选择合适的实验方法分离下列混合物,用代表整套装置的字母填空;
①从氯化钾溶液中得到氯化钾固体,选择装置____________;
②分离饱和食盐水与沙子的混合物,选择装置____________;
③除去自来水中的Cl-等杂质以制取蒸馏水,选择装置____________;
④分离乙醇和水的混合物,选择装置________;
⑤分离汽油和水的混合物,选择装置____________;
(3)分离碘和水的混合物,可选择下列哪种试剂?_______(填序号),所用分离方法为________。
A.四氯化碳 B.乙醇 C.蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;“滤渣A”主要成份的化学式为 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O=15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 ;
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)________________。
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法正确的是( )
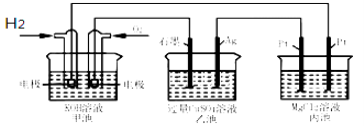
A.甲池通入O2的电极反应为O2 + 4e-+ 4H+=2H2O
B.乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、生石膏、冰醋酸、氯化银
④同素异形体:C60、C70、金刚石、石墨
A. ①③ B. ②③ C. ③④ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关摩尔的使用正确的是( )
A.1mol O的质量为16g·mol-1
B.0.5mol He约含有6.02×1023个电子
C.2H既表示2个氢原子又表示2mol氢原子
D.每摩尔物质均含有6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)NH4++OH-=NH3↑+H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO(2)微溶物在溶液中不能大量存在,会沉淀而析出某强酸性的X 溶液中可能含有 Fe2+、 A13+、 NH4+、 CO32―、 SO32―、 SO42―、 C1―中的若干种,现取 X溶液进行连续实验,实验过程及产物如下:
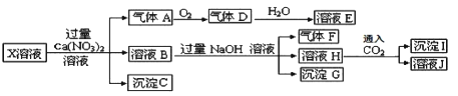
下列说法正确的是( )
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是A13+和C1―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,△H= kJ·mol-1。
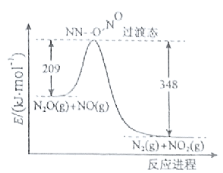
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com