
| 实验序号 | 一 | 二 | 三 | 四 |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A、实验一反应后溶液中含有Fe3+、Fe2+、Cu2+ |
| B、实验二、三反应后剩余固体全部是Cu |
| C、实验四的滤液中c(Fe2+)=1.5mol?L-1 |
| D、原粉末样品中m(Fe):m(Cu)=7:8 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移电子个数为2moL |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、某无色溶液中通入Cl2,溶液变为棕黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCH4与Cl2发生取代反应最多消耗2molCl2 | ||
| B、乙酸乙酯的水解属于取代反应 | ||
C、CH3-CH═CH2+Cl2
 属于加成反应 属于加成反应 | ||
D、甲苯硝化生成三硝基甲苯的化学方程式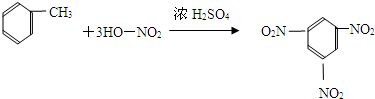 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| HBr |
| NaOH |
| 水/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水加热到很高的温度都难分解是因为水分子中存在氢键 |
| B、蔗糖、淀粉、蛋白质及其水解产物均为非电解质 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、不用任何试剂即可鉴别Na2CO3溶液和NaHSO4溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 目的 |
| A | 电解精炼 | 将粗铜转化为精铜 |
| B | 蒸馏 | 分离氯化钠和硝酸钾混合溶液 |
| C | 分液 | 分离乙酸与乙酸乙酯混合物 |
| D | 用乙醇作萃取剂 | 提取溴水中的溴单质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com