
在水溶液中能大量共存的一组离子是
A.Fe2+、Al3+、ClO—、Cl— B.K+、Cu2+、OH、NO3—
C.NH4+、Na+、Br—、SO42— D.Mg2+、H+、SiO32-、SO42-
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。

① Ni原子的价电子排布式是 。
② 该合金储氢后,含1mol La的合金可吸附H2的数目为 。
(2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是 。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是 。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是 ,其中心原子N的杂化方式是 。
(4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原子。在二氧化硅晶体的一个晶胞中,含有 个化学键。原子晶体能否形成最密堆积结构,原因是 。
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:选择题
某澄清溶液中可能含有下列离子中的几种:Na+、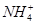 、Fe2+、Fe3+、Ba2+、
、Fe2+、Fe3+、Ba2+、 、
、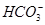 、Cl-。对其进行如下实验:①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;③取②中上层清液加入酸化的硝酸银溶液,也生成白色沉淀。下列关于该溶液的说法中正确的是
、Cl-。对其进行如下实验:①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;③取②中上层清液加入酸化的硝酸银溶液,也生成白色沉淀。下列关于该溶液的说法中正确的是
A.该溶液中一定不存在Ba2+和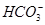
B.取③中滤液加入KSCN,溶液显血红色,则原溶液中一定有Fe3+
C.该溶液中一定存在 和Cl-
和Cl-
D.另取该溶液加入少量稀NaOH溶液,微热,试管口的湿润红色石蕊试纸不变蓝,则原溶液中一定不存在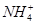
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式正误判断(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O=NO3-+NO+2H+
C.醋酸溶液水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0. 1 mol·L-1AgNO3溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2溶液: H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的NaI溶液:K+、H+、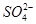 、
、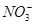
B.0.1 mol·L-1的NaHCO3溶液:K+、Na+、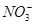 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、Na+、ClO-、Cl-
D.0.1 mol·L-1的氨水:Cu2+、Na+、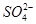 、
、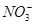
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
根据下列条件计算有关反应的焓变:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)===2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解三池的应用(解析版) 题型:选择题
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是
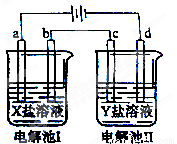
选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com