
【题目】室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是
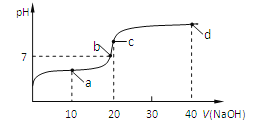
A.a点时:c(CH3COOH) c(CH3COO-) c(H+) c(Na+) c(OH-)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+) c(OH-) c(CH3COO-) c(H+)
【答案】BD
【解析】a点时,二者反应后相当于等浓度的CH3COOH与CH3COONa溶液,由于酸的电离大于盐的水解,故: c(CH3COO-) c(Na+) c(CH3COOH) c(H+) c(OH-);
b点时正好呈中性,由电荷守恒可知正确;c点时,二者反应后即是CH3COONa溶液,电荷守恒:c(Na+) + c(H+)= c(CH3COO-) + c(OH-) ①,物料守恒:c(Na+) =c(CH3COOH) + c(CH3COO-) ②,将②代入①式可知:c(OH-)=c(H+)+c(CH3COOH);d点时,二者反应后相当于等浓度的NaOH与CH3COONa溶液,根据物料守恒和电荷守恒即可得出:c(Na+) c(OH-) c(CH3COO-) c(H+)


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL a mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:

(1)称量粗盐样品m g,在托盘天平左盘上放________,右盘上放_______。
(2)蒸发操作时应将液体放在________中加热,等加热至________时即停止加热。
(3)在样品的溶液中加入过量的Na2CO3溶液,作用是_________________________________,
反应的化学方程式是______________________________________________________。
(4)在滤液中加入盐酸的作用是____________________________________,
反应的化学方程式是____________________________________________。
(5)配制100 mL a mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)燃料电池的工作原理如右图,有关叙述正确的是

A. 该装置能实现化学能100%转化为电能
B. 电子移动方向为:a极→b极→质子交换膜→a极
C. a电极的电极反应式为:CH3OCH3+3H2O=2CO2+12e-+12H+
D. 当b电极消耗22.4LO2时,质子交換膜有4moIH+通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
A.16O2与18O2互为同分异构体
B.16O和18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列关于溶液中的量的关系判断正确的是
A. H+浓度:10c(H+)甲=c(H+)乙 B. OH-浓度:c(OH-)甲=10c(OH-)乙
C. 溶液浓度:c(甲)>10c(乙) D. 与等量NaOH反应耗酸体积:10V(甲)>V(乙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅酸钠以下说法不正确的是( )
A. 硅酸钠与盐酸反应的离子方程式:SiO32—+2H+=H2SiO3↓
B. 硅酸钠溶液俗称“泡花碱”,其溶液显碱性,滴加酚酞显红色
C. Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
Na2SiO3+CO2↑,说明硅酸酸性比碳酸强
D. 水玻璃久置在空气中变质,因为与空气中的CO2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质的重要组成元素之一,以氮气为原料的合成氨工业可以实现大规模固氮,氨可用于生成氯化铵、硫酸铵等化学肥料。
(1)科学家已成功合成少量N4分子,N4和N2互为_____,NH3分子的空间构型为型______。
(2)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标况下)氮气,至少需要叠氮酸钠_____g,转移电子____个。
(3)检验铵态氮肥中铵根离子的实验方案是(补充写出步骤,现象):取样,溶于水_________________________________________________。
(4)等物质的量浓度的两溶液,pH大小为:氯化铵__________硫酸铵(选填>、=或< ,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵_____硫酸铵;
最新“人工固氮”的研究报道:常温常压、催化剂条件下, N2在催化剂表面与水发生反应:与水发生反应: 2N2(g)+6H2O(g)![]() 4NH3(g)+3O2(g)-Q,(Q>0)
4NH3(g)+3O2(g)-Q,(Q>0)
(5)如果反应的平衡常数K值变小,该反应正反应速率_______ (选填增大、减小或不变,下同),逆反应速率_______.
(6)若反应在恒容条件下进行,请用上述反应中的有关物理量来说明该反应已达到平衡状态_______.
(7)下列能够提高氮气转化率的措施是:_____
A.适当升高温度 b.增加水的用量
C.使用高效催化剂 d.扩大容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示则

A. M点所示溶液的导电能力强于Q点
B. N点所示溶液中c(CH3COO-)>c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
![]()
![]()
![]()
![]()
![]()
试回答:
(1)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)________________,检验此C溶液中金属元素价态的操作方法是__________。
(2)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为____________或_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com