
【题目】下列说法中正确的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分别通入乙烯加入苯,都能观察到溴水褪色现象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2两种同分异构体
C—CH=CH2两种同分异构体
D. 芳香烃![]() 和
和![]() 的一氯代物都只有2种
的一氯代物都只有2种
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为______________________。
(3)沉淀B的化学式为___
II.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
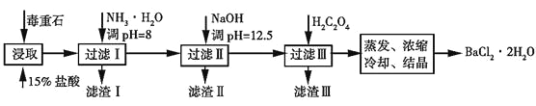
(4)毒重石用盐酸浸取前需充分研磨,目的是___________________________________。
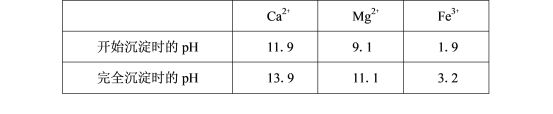
(5)滤渣Ⅱ中含________________(填化学式)。加入H2C2O4时应避免过量,原因是______________________。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS杂质,由此矿石生产MnCO3的工艺流程如图所示:


已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸______(填“是”或“否”);操作I的名称为______________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS发生反应的离子方程式:______。
(3)调节溶液Ⅰ的pH时,pH的范围为_________;所用的物质X最好是________(填字母)。
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体
(4)滤渣Ⅰ为___________________,滤渣Ⅱ为_____________。(填化学式)
(5)沉锰的化学方程式为_________________________________________。
(6)沉锰后过滤得到固体MnCO3,设计实验方案验证MnCO3固体是否洗涤干净:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
(1)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下:
WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) K=__________。
W(s)+3H2O(g) K=__________。
(2)T1℃时,将4molH2和足量WO3置于2 L密闭容器中,发生反应:WO3(s)+3H2(g)![]() W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:

①下列选项中能说明反应已经达到平衡的是_________。(填字母)
a.反应速率ν(H2)=ν(H2O)
b.每断裂3molH-H键的同时断裂3molO-H键
c.反应热不变
d.混合气体的密度不再改变
e.体系的压强不再改变
②反应在2min时达到平衡,此时H2的平衡转化率a=_________%。
③若在4min时升高并维持温度为T2℃,变化如图所示,则该反应的△H_______0,若在8min时缩小容器容积,则![]() ________1.3。(填“>”“ <”或“=”)
________1.3。(填“>”“ <”或“=”)
(3)利用电解法可以从合金碳化钨(WC)废料中回收钨元素(合金中钨、碳均为单质)。电解时,用合金碳化钨做阳极,不锈钢做阴极,盐酸溶液为电解液,阳极析出钨酸(H2WO4)并放出CO2。该阳极的电极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列热化学反应方程式作出的判断正确的是
①CH4(g) + ![]() O2(g)= CO (g)+ 2H2O(g)
O2(g)= CO (g)+ 2H2O(g) ![]() H1 = a kJ·mol-1
H1 = a kJ·mol-1
②CH4 (g)+ 2O2(g)= CO2(g) + 2H2O(g) ![]() H2 = b kJ·mol-1
H2 = b kJ·mol-1
③C (s)+ ![]() O2 (g) = CO (g)
O2 (g) = CO (g) ![]() H3= c kJ·mol-1
H3= c kJ·mol-1
④H2 (g)+ ![]() O2 (g)=H2O (l)
O2 (g)=H2O (l) ![]() H4 =d kJ·mol-1
H4 =d kJ·mol-1
A. a>b
B. a + c<b
C. 2CO (g)+O2 (g) =2CO2 (g)的![]() H =(b-a)kJ·mol-1
H =(b-a)kJ·mol-1
D. CO (g) + H2O (g)=CO2 (g)+H2 (g)的![]() H =(b-a-d)kJ·mol-1
H =(b-a-d)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL溴乙烷,振荡。
实验操作Ⅱ:将试管如图固定后,水浴加热。

(1)用水浴加热而不直接用酒精灯加热的原因是_________;试管口安装一长导管的作用是________________________。
(2)观察到________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是_____________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是________________,检验的方法是______________________________说明所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四个起始容积相同的密闭容器中充入表中所示气体及相应的量,加入催化剂并控制温度、容积或压强,发生反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g) ![]() H<0,直至达平衡。下列说法错误的是
H<0,直至达平衡。下列说法错误的是
编号 | 条件 | 起始物质的量/mol | ||||
温度/℃ | 容积或压强 | CO(g) | NO (g) | CO2 (g) | N2 (g) | |
① | 600 | 维持恒容 | 0.2 | 0.2 | 0 | 0 |
② | 700 | 维持恒容 | 0.1 | 0.1 | 0.1 | 0.05 |
③ | 600 | 维持恒容 | 0.4 | 0.4 | 0 | 0 |
④ | 600 | 维持恒压 | 0.4 | 0.4 | 0 | 0 |
A. 平衡时N2的浓度:①>②
B. 平衡时CO的正反应速率:①<②
C. NO的平衡转化率:③>①
D. 平衡时容器内气体总压:④>③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com