
| A. | 8.5 | B. | 17 | C. | 22 | D. | 34 |
分析 设A的物质的量为2mol,由方程式可知,若A完全分解混合气体总物质的量为4mol,根据混合气体相对氢气密度计算混合气体的相对分子质量;若A完全不反应,根据m=nM计算混合气体总质量,由质量守恒定律可知A的质量等于混合气体总质量,再根据M=$\frac{m}{n}$计算A的相对分子质量,则A的相对分子质量介于上述两极值之间.
解答 解:设A的物质的量为2mol,
若A完全反应,由方程式2A=B+3C可知混合气体总物质的量为:1mol+3mol=4mol,混合气体对氢气的相对密度为8.5,则混合气体平均相对分子质量=2×8.5=17,
混合气体的总质量=4mol×17g/mol=68g;
若A不水解,由质量守恒定律可知A的质量为68g,则A的摩尔质量为:$\frac{68g}{2mol}$=34g/mol,相对分子质量为34,
所以A的相对分子质量介于17~34之间,满足条件的为C,
故选C.
点评 本题考查化学方程式的计算,题目难度不大,明确极值法、平均值法在化学计算中的应用方法为解答关键,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:推断题
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和K2SO4溶液反应 | B. | Al放入烧碱溶液中 | ||
| C. | NaOH溶液和CuSO4溶液反应 | D. | KSCN溶液和FeCl3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液的导电能力和pH值均相同 | |
| B. | 中和两溶液,消耗NaOH的物质的量相同 | |
| C. | 分别与足量的Zn完全反应,盐酸产生的速率快,氢气多 | |
| D. | 当把两种酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,则有c(H+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
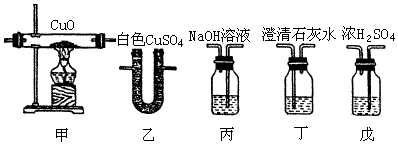
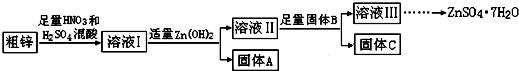
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠;②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加AgNO3溶液和稀硝酸 | 若溶液变浑浊,结合步骤2中的①,则假设一成立;结合步骤2中的②,则假设二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
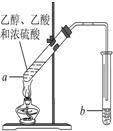 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com