
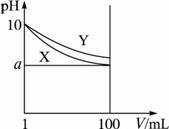
A.X、Y两种碱溶液中溶质的物质的量浓度一定相等?
B.稀释后,X溶液的碱性比Y溶液的碱性强?
C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积V(X)>V(Y)?
D.若8<a<10,则X、Y都是弱碱?
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、强酸溶液的pH值一定比弱酸溶液小 | B、pH值等于7的溶液,一定是中性的溶液 | C、常温下,由水电离出的c(H+)=10-12mol/L,则溶液pH一定为12 | D、常温下,pH=10的氨水溶液中,OH-总浓度与由水电离出的OH-浓度之比为106 |
查看答案和解析>>
科目:高中化学 来源: 题型:

A.X、Y两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY
D.若8<a<10,则X、Y都是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
A.如果是盐溶液,则a>8;如果是碱溶液,则a≥8
B.如果是盐溶液,则a≥8;如果是碱溶液,则a>8
C.如果是盐溶液,则a=8;如果是碱溶液,则a=8
D.如果是盐溶液,则a>12;如果是碱溶液,则a≥12
查看答案和解析>>
科目:高中化学 来源:2014届江西省高二第二次月考化学试卷(解析版) 题型:填空题
(15分)(Ⅰ)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为__________。
(Ⅱ)常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性,生成的盐化学式为___________。AOH与HnB完全中和所得溶液呈_________性,其原因用离子方程式表_______________________________________。
(Ⅲ)常温下将体积为v1、浓度为c1的一元酸HA与体积为v2、浓度为c2的一元碱BOH混合。
(1)若v1·c1=v2·c2,混合后的溶液pH>7,则一元弱酸的电离程度 (选填“>”、“<”或“=”)一元弱碱的电离程度;
(2)若v1=v2,一元弱碱的电离程度大于一元弱酸的电离程度,且混合后溶液pH<7,则c1 c2(选填“>”、“<”或“=”)。
(Ⅳ)常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为 (填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(Ⅴ)将硫酸铝溶液和碳酸氢钠溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com