
分析 (1)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-;
(2)CH3COONa溶液中,醋酸根水解,促进水的电离,所以溶液中水电离出的氢氧根离子就是溶液中的氢氧根离子,CH3COOH溶液中,水电离受到抑制,水电离出来的氢离子等于溶液中的氢氧根离子,据此计算;
(3)NaHSO4是强电解质,在水中完全电离出钠离子、氢离子和硫酸根离子;
(4)FeCl2溶液易被氧气氧化为氯化铁,根据三氯化铁在溶液中存在水解平衡,从平衡移动的角度分析并解答该题;
(5)先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=$\frac{n(碱)-n(酸)}{V(酸)+V(碱)}$计算.
解答 解:(1)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,因CO32-水解水解显碱性,且第一步水解大于第一步电离,则离子浓度关系为:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+),
故答案为:碱;CO32-+H2O?HCO3-+OH-;c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);
(2)pH=11的CH3COONa溶液中,醋酸根水解,促进水的电离,所以溶液中水电离出的氢氧根离子就是溶液中的氢氧根离子,水电离出来的c(OH-)=$\frac{10{\;}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,在pH=3的CH3COOH溶液中,水电离受到抑制,水电离出来的氢离子等于溶液中的氢氧根离子,水电离出来的c(H+)=$\frac{10{\;}^{-14}}{10{\;}^{-3}}$mol/L=10-11mol/L,
故答案为:10-3;10-11;
(3)NaHSO4是强电解质,在水中完全电离出钠离子、氢离子和硫酸根离子,电离方程式为:NaHSO4=Na++H++SO42-;
故答案为:NaHSO4=Na++H++SO42-;
(4)FeCl2溶液易被氧气氧化为氯化铁,在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热使Fe(OH)3分解生成Fe2O3,故答案为:Fe2O3;
(5)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L×0.001mol/L,则:V2=$\frac{0.01mol/L×0.1L}{0.001mol/L}$=0.9L=900mL,
pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,
设加入pH=10的NaOH溶液体积是V2,c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),
解得:V2=1L=1000mL,
盐酸的浓度是0.01mol/L,设加入盐酸的体积是V,c(OH-)=$\frac{n(碱)-n(酸)}{V(酸)+V(碱)}$=$\frac{0.01mol/L×0.1L-0.01mol/L×VL}{(0.1+V)L}$=0.001mol/L,
解得:V=81.8mL,
故答案为:900;1000;81.8.
点评 本题综合考查盐类水解的原理以及影响平衡移动的因素以及酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液pH的计算方法为解答关键,试题侧重考查学生达到分析、理解能力及化学计算计算能力.


科目:高中化学 来源: 题型:解答题
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度(mg/L) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度(mg/L) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
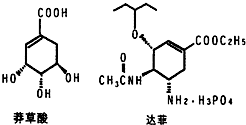 目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).
目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).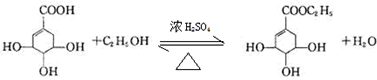 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质铁与盐酸的反应 Fe+2 H+=Fe2++H2↑ | |
| B. | 氨水跟硫酸发生酸碱中和反应 OH-+H+=H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙加入醋酸溶液中 CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 冶炼原理 | 方法 | |
| A | 2HgO$\frac{\underline{\;加热\;}}{\;}$2Hg+O2↑ | 热分解法 |
| B | 2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑ | 电解法 |
| C | Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | 热分解法 |
| D | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | 热还原法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O和NH4Cl(s)混合反应 | B. | 生石灰和水的反应 | ||
| C. | 液态水气化 | D. | 盐酸与氢氧化钠溶液的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com