
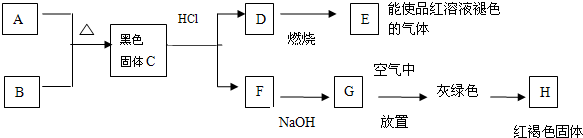
分析 D燃烧得到气体E能使品红溶液褪色,则E为SO2,F与NaOH反应得到G,而G放置空气中变为灰绿色,最终变为红褐色固体H,则G为 Fe(OH)2,H为 Fe(OH)3,黑色粉末单质A与黄色粉末单质B反应得到黑色固体C,而C与盐酸反应得到D与F,可推知A为Fe、B为S,C为FeS,D为H2S,F为FeCl2,据此解答.
解答 解:D燃烧得到气体E能使品红溶液褪色,则E为SO2,F与NaOH反应得到G,而G放置空气中变为灰绿色,最终变为红褐色固体H,则G为 Fe(OH)2,H为 Fe(OH)3,黑色粉末单质A与黄色粉末单质B反应得到黑色固体C,而C与盐酸反应得到D与F,可推知A为Fe、B为S,C为FeS,D为H2S,F为FeCl2.
(1)根据上述反应现象推断,A为Fe,D为H2S,E为SO2,H为Fe(OH)3,
故答案为:Fe;H2S;SO2;Fe(OH)3;
(2)C+盐酸→D+F的离子方程式:FeS+2H+=Fe2++H2S↑,
故答案为:FeS+2H+=Fe2++H2S↑;
(3)D→E的化学方程式:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
故答案为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O.
点评 本题考查无机物推断,物质的颜色及反应现象是推断突破口,需要学生熟练掌握元素化合物知识,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列叙述中错误的是( )
,下列叙述中错误的是( )| A. | 它们属于不同元素 | |
| B. | 它们都是离子 | |
| C. | 它们的最外层都具有稀有气体原子的稳定结构 | |
| D. | 它们的核外电子排布均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先①后② | B. | 先②后① | C. | 先②后③ | D. | 先③后② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把Cr、Ni等金属加入到普通钢里制成不锈钢铁 | |
| B. | 通过特殊工艺,增加铝制品表面的氧化膜 | |
| C. | 对于易生锈的铁制品要定期刷防护漆 | |
| D. | 镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com