
【题目】已知在碱性溶液中可发生如下反应:R(OH)3+2ClO﹣+4OH﹣═RO4n﹣+3Cl﹣+5H2O.则RO4n﹣ 中R的化合价是( )
A.+7
B.+6
C.+5
D.+4
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。25℃时,向40ml浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是

A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) < c(CH3COOH)
C. c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-)
D. d点水的电离程度大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀士氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:

已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
(1)焙烧过程中发生的主要反应方程式为____________________________________。
(2)“萃取”时存在反应:Ce4+ +n(HA)2![]() Ce·(H2n-4A2n)+4H+。
Ce·(H2n-4A2n)+4H+。
①实验室中萃取时用到的主要玻璃仪器为烧杯和__________________。
②右图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:____________________________________ 。
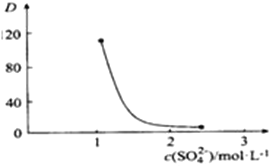
③在D=80的条件下,取20mL含四价铈总浓度为0. 1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2,充分振荡,静置,水层中c(CeSO42+)=_________。 (结果保留三位有效数字)
(3) “反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作用与下列反应中H2O2的作用相同的是____________。
A. H2O2和MnO2混合制O2 B.用H2O2处理含酸性K2Cr2O7的废水
C.H2O2和CaO混合制备CaO2 D.用稀硫酸和H2O2的混合液溶解金属Cu
(4)溶液中c(Ce3+)等于1.0×10-5mol·L-1,可认为Ce3+沉淀完全,此时溶液的pH为______________,
(已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 _____________________________________ 。
(5)取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,则该产品中CeO2的质量分数为______ %;下列选项可能使测定结果偏低的是__________。
A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向XmL0.01mol/L的氨水中滴加等物质的量浓度的H2SO4溶液,测得混合溶液的POH=—lgc(OH-)、温度随加入的硫酸溶液体积的变化如图所示。下列说法正确的是

A. X=20
B. b点时溶液的POH=PH
C. a,b,d三点NH3·H2O的电离常数: K(b)>K(d)>K(a)
D. c点对应的溶液中:C(SO42-)>C(NH4+)>C(H+)>C(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为54,对应原子最外层电子数之和为20。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,该反应的离子方程式为______________________________________________________。
(2)X与W可形成X2W和X2W2两种化合物,X2W2的电子式为_____________。
(3)Q与W可形成化合物QW2,这种化合物固态时属于________晶体。
(4)Y的硝酸盐水溶液显________性,用离子方程式解释原因___________________。
(5)Z的氢化物与W的氢化物发生反应生成Z的单质和水,其化学方程式为_____________________。
(6)W、X、Y、Z四种元素原子半径由大到小的顺序是:________(用元素符号表示)。
(7)0.5 mol Q的单质与足量的W单质完全反应,放出196.75 kJ的热量。写出该反应的热化学方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A 是生活中一种常见的调味品,B 是最常见的无色液体,X、Y是两种常见的金属单质。D、E、F为气体,且 E为黄绿色,F能使品红溶液褪色,E 与 F 以等物质的量反应。请回答下列问题:
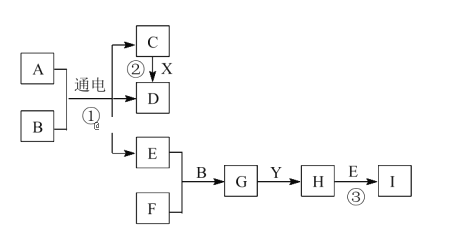
(1)F的化学式是________。溶液 G 中含有的主要离子为_____________(用离子符号表示)。
(2)反应②的化学方程式为___________________。
(3)反应③的离子方程式为________________________________。
(4)请补充完整检验H中阳离子的实验方案:取少量H中的溶液于试管中,_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行①中实验,对应②中现象正确,且能达成相应实验目的的是( )
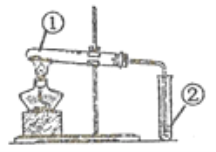
选项 | ①中实验 | ②中现象 | 实验目的 |
A | 将浸透石蜡油的石棉加热 | Br2的CCl4溶液褪色 | 石蜡裂解产物中含有烯烃 |
B | 加热NH4Cl固体 | 酚酞溶液变红 | 制备氨气并检验氨气性质 |
C | 加热NaHCO3与Na2CO3混合粉末 | 澄清石灰水变浑浊 | 验证NaHCO3具有热不稳定性 |
D | 加热铁粉及湿棉花 | 肥皂水中有气泡冒出 | Fe与H2O发生了置换反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年,具有超常性能的铝离子电池成为研究热点,其可在一分钟内完成充放电。铝与石墨为电极,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法错误的是
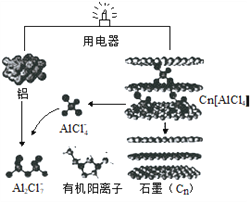
A. 放电时,有机阳离子向石墨电极方向移动
B. 放电时,正极的电极反应式为:Cn[AlCl4]+e-=Cn+AlCl4-
C. 充电时,每生成1mol铝,同时消耗4molAl2Cl7-
D. 充电时铝电极接电源负极,该极有Cn[AlCl4]生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com