
【题目】碘酸钾(![]() )是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中
)是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中![]() 的纯度:
的纯度:
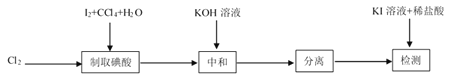
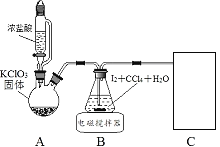
其中制取碘酸(![]() )的实验装置见图,有关物质的性质列于表中
)的实验装置见图,有关物质的性质列于表中
物质 | 性质 |
HIO3 | 白色固体,能溶于水,难溶于CCl4 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生氧化反应:ClO-+IO3-=IO4-+Cl- |
回答下列问题
(1)装置A中参加反应的盐酸所表现的化学性质为______________。
(2)装置B中反应的化学方程式为___________________ 。B中所加CCl4的作用是_________从而加快反应速率。
(3)分离出B中制得的![]() 水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低
水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低![]() 的产率。
的产率。
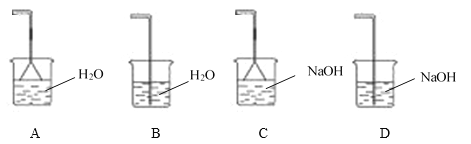
(4)为充分吸收尾气,保护环境,C处应选用最合适的实验装置是____________(填序号)。
(5)为促使![]() 晶体析出,应往中和所得的
晶体析出,应往中和所得的![]() 溶液中加入适量的___________。
溶液中加入适量的___________。
(6)取1.000g![]() 产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L
产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L![]() 溶液滴定。滴定至终点时蓝色消失(
溶液滴定。滴定至终点时蓝色消失(![]() ),测得每次平均消耗
),测得每次平均消耗![]() 溶液25.00mL。则产品中
溶液25.00mL。则产品中![]() 的质量分数为___(结果保留三位有效数字)。
的质量分数为___(结果保留三位有效数字)。
【答案】还原性、酸性 ![]() 充分溶解
充分溶解![]() 和
和![]() ,以增大反应物浓度 分液 除去
,以增大反应物浓度 分液 除去![]() (或
(或![]() ),防止氧化
),防止氧化![]() C 乙醇(或酒精) 89.5%。
C 乙醇(或酒精) 89.5%。
【解析】
装置A用于制取Cl2,发生的反应为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,装置B中发生的是制取HIO3的反应,装置C为尾气处理装置,既要吸收尾气中的HCl和Cl2,还要防止倒吸。
(1)装置A中发生的反应为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,浓盐酸中的Cl元素有一部分失电子转化为Cl2,表现出还原性,还有一部分Cl元素没有变价转化为KCl(盐),表现出酸性,故答案为:还原性、酸性;
(2)装置B中发生的反应为:5Cl2+I2+6H2O=2HIO3+10HCl,Cl2和I2均难溶于水,易溶于CCl4,加入CCl4可使二者溶解在CCl4中,增大反应物浓度,故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;充分溶解I2和Cl2,以增大反应物浓度;
(3)分离B中制得的HIO3水溶液的操作为分液,HIO3溶液中混有的Cl2在碱性条件下转化为ClO-,ClO-会将IO3-氧化为IO4-,因此在中和前需要将Cl2除去,故答案为:分液;除去Cl2(或ClO-),防止氧化KIO3;
(4)尾气中主要含HCl和Cl2,需用NaOH溶液吸收,同时要防止倒吸,故答案为:C;
(5)因为KIO3难溶于乙醇,向KIO3溶液中加入乙醇可降低其溶解度,促使KIO3晶体析出,故答案为:乙醇(或酒精);
(6)每20mLKIO3溶液中,加入KI溶液和稀盐酸发生的反应为:IO3-+5I-+6H+=3I2+3H2O,滴定时发生的反应为:I2+2S2O32-=2I-+S4O62-,可列出关系式:IO3-~3I2~6S2O32-,每次平均消耗的n(S2O32-)= 0.1004mol/L×0.025L=0.00251mol,则每20mLKIO3溶液中,n(KIO3)=n(IO3-)= n(S2O32-)÷6=0.00251mol÷6=0.000418mol,200mL溶液中,n(KIO3)=0.00418mol,产品中KIO3的质量分数=![]() =89.5%,故答案为:89.5%。
=89.5%,故答案为:89.5%。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】金属镁享有“国防金属”的美誉,目前世界上百分之六十的镁是从海水中提取的,主要反应为:MgCl2+Ca(OH) 2=Mg(OH) 2↓+CaCl2。若往200mL浓缩海水中加入0.37g Ca(OH)2使Mg2+沉淀完全,请计算:
(1)生成沉淀的物质的量________。
(2)该浓缩海水中Mg2+的物质的量浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取一定量冰醋酸,进行如下实验:
① 将冰醋酸配制成0.1 mol·L-1醋酸溶液;
② 取20 mL①所配溶液,加入a mL 0.1 mol·L-1 NaOH溶液,充分反应后,测得溶液pH=7;
③ 向②所得溶液中继续滴加稀盐酸,直至溶液中n(Na+) = n(Cl-)。
下列说法正确的是
A.①中:所得溶液的pH=1
B.②中:a=20
C.③中:所得溶液中c(CH3COO-)<c(H+),且pH<7
D.①与③所得溶液相比,等体积时所含CH3COOH分子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为高中化学教材《必修1》(人教版)中NaCl在水中的溶解和电离示意图。下列由此得出的说法中,错误的是
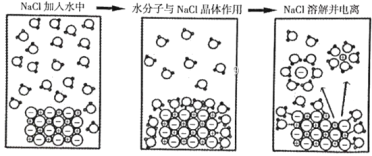
A.在H2O分子中,H或O原子均完全不带电荷
B.在NaCl晶体中,Na+和Cl-的排列整齐有序
C.Na+、Cl![]() 在水中是以水合离子的形式存在
在水中是以水合离子的形式存在
D.NaCl晶体的溶解和电离过程破坏了离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“吸收—电解”循环法脱除烟气中的SO2,可减少对大气的污染。室温下,电解液K再生的装置如图所示,其中电解液的pH随![]() 变化的关系见下表,下列对此判断正确的是
变化的关系见下表,下列对此判断正确的是
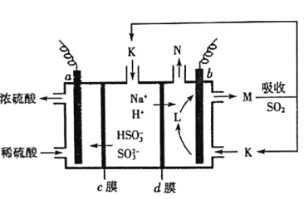
电解液 | n(SO32-):n(HSO3-) | pH |
K | 9:91 | 6.2 |
L | 1:1 | 7.2 |
M | 91:9 | 8.2 |
A.当电解液呈中性时溶液中:![]()
B.再生液M吸收SO2主反应的离子方程式为:![]()
C.HSO3-在b极发生的电极反应式为:![]()
D.若产生标准状况下2.24L气体N,则d膜上共通过0.2mol阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组利用如图装置来制备无水AlCl3(已知:无水AlCl3遇水能迅速发生反应)。下列说法正确的是
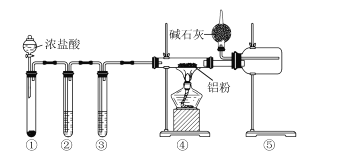
A.装置①中的试剂可能是二氧化锰
B.装置②、③中的试剂分别为浓硫酸、饱和食盐水
C.点燃④处酒精灯之前需排尽装置中的空气
D.球形干燥管中碱石灰的作用只有处理尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,分别向20mL浓度均为xmol/L的NaCl和Na2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中![]() 和
和![]() 与AgNO3溶液的体积关系如图所示。下列说法不正确的是
与AgNO3溶液的体积关系如图所示。下列说法不正确的是
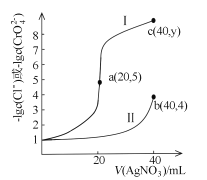
A.x =0.1B.曲线I代表NaCl溶液
C.Ksp(Ag2CrO4)约为4×10-12D.y=9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水处理在工业生产和科学实验中意义重大,处理方法很多,其中离子交换法最为简单快捷,如图是净化过程原理。有关说法中正确的是( )
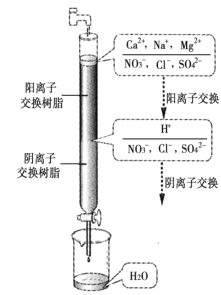
A.经过阳离子交换树脂后,水中阳离子的总数未发生变化
B.通过阳离子交换树脂时,H+则被交换到水中
C.通过净化处理后,水的导电性不变
D.阳离子树脂填充段存在反应H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO=2PbSO4+2H2O

研读右图,下列判断不正确的是
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的![]() 为0.2mol
为0.2mol
C.K闭合时,Ⅱ中![]() 向c电极迁移
向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com