
| A. | 乙酸分子比例模型: | |
| B. | 原子核内有18个中子的原子:${\;}_{17}^{35}$Cl | |
| C. | 1,2-二溴乙烷的结构简式:C2H4Br2 | |
| D. | 过氧化氢电子式: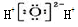 |
分析 A.图为乙醛的比例模型;
B.氯原子的核电荷数为17,质量数=质子数+中子数;
C.根据2个溴原子分布在不同的碳原子上;
D.过氧化氢为共价化合物.
解答 解:A.乙酸分子比例模型: ,故A错误;
,故A错误;
B.Cl的质子数为17,中子数为18,质量数为35,可表示:${\;}_{17}^{35}$Cl,故B正确;
C.1,2-二溴乙烷的结构简式为:CH2BrCH2Br,故C错误;
D.过氧化氢为共价化合物,电子式为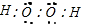 ,故D错误;
,故D错误;
故选B.
点评 本题主要考查了常见化学用语的表示方法,题目难度不大,涉及电子式、比例模型、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A | B | C | F |
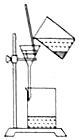 |  | 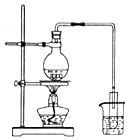 |  |
| 分离胶体和溶液 | 蒸发海水制备粗盐 | 实验室制取少量蒸馏水 | 用CCl4提取溴水中的Br2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(硝基苯) | B. | 乙醇(乙酸) | C. | 乙酸乙酯(乙酸) | D. | 乙酸(苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,加入铝粉能够产生氢气的溶液中水电离的c(H+)一定小于10-7mol•L-1 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含Cl-、CrO42-浓度相同的溶液中滴加稀AgNO3溶液时,先生成Ag2CrO4沉淀 | |
| C. | 温度一定时,强电解质溶液的导电能力一定比弱电解质溶液强 | |
| D. | 实验室用锌制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
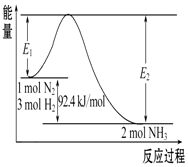 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.| t℃ | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
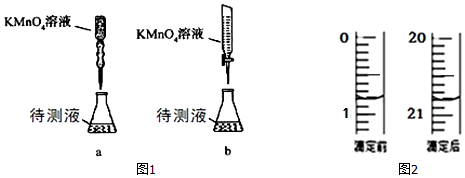
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
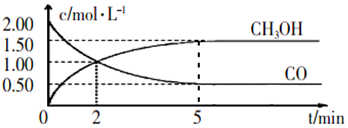
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com