
【题目】一些烷烃的燃烧热如下表:
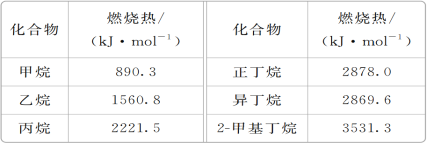
下列表达正确的是( )
A. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1
B. 稳定性:正丁烷>异丁烷
C. 正戊烷的燃烧热大于3531.3 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
【答案】C
【解析】
A项,乙烷的燃烧热为1560.8kJ/mol,指1molC2H6(g)完全燃烧生成CO2(g)和H2O(l)放出1560.8kJ的热量,乙烷燃烧热表示的热化学方程式为C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l)ΔH=-1560.8kJ/mol,A项错误;
O2(g)=2CO2(g)+3H2O(l)ΔH=-1560.8kJ/mol,A项错误;
B项,正丁烷和异丁烷互为同分异构体,1mol正丁烷和异丁烷完全燃烧都生成4molCO2(g)和5molH2O(l),正丁烷的燃烧热>异丁烷的燃烧热,则正丁烷具有的能量>异丁烷具有的能量,根据能量越低越稳定,稳定性:正丁烷<异丁烷,B项错误;
C项,正戊烷和2—甲基丁烷互为同分异构体,根据正丁烷的燃烧热>异丁烷的燃烧热知,互为同分异构体的化合物支链多的燃烧热小,正戊烷的燃烧热>2—甲基丁烷的燃烧热,正戊烷的燃烧热大于3531.3kJ/mol,C项正确;
D项,随着碳原子数的增多烷烃含碳质量分数逐渐增大,1gCH4、C2H6、C3H8完全燃烧放出的热量依次为55.64kJ(![]() =55.64kJ)、52.03kJ(
=55.64kJ)、52.03kJ(![]() =52.03kJ)、50.49kJ(
=52.03kJ)、50.49kJ(![]() =50.49kJ),可见相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少,D项错误;
=50.49kJ),可见相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少,D项错误;
答案选C。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入足量的下列溶液中,既能生成气体,又能生成白色沉淀的是( )
A.稀硫酸B.Ba(OH)2稀溶液C.MgCl2溶液D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是
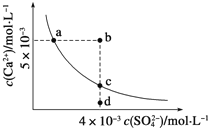
A. a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B. a点对应的Ksp等于c点对应的Ksp
C. b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3molL-1
D. 向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、中和热的测定实验中取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题:
(1) 从下图实验装置看,其中尚缺少的一种玻璃用品是__________。

温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(2) 若0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以上数据计算中和热ΔH=_______( 结果保留小数点后一位)。
(3) 若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”或“不相等”)
Ⅱ、在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼和足量液态H2O2反应生成氮气和水蒸气时放出256.64 kJ的热量。写出肼和H2O2反应的热化学方程式:___________。
Ⅲ、(1)将pH=8的氢氧化钡溶液与pH=5的盐酸溶液混合并保持100℃恒温,欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为________。
(2)已知AnBm的离子积K=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下,氢氧化钙溶解度为0.74 g,其饱和溶液密度设为1 g·cm-3,其离子积为K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应起了氮的固定作用是( )
A.N2和H2在一定条件下反应生成NH3B.硝化细菌分解铵盐生成硝酸盐
C.NO与O2反应生成NO2D.由NH3制碳铵或硫铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )

A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应剧烈
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为_____________B池为____________
(2)铜极为__________极,电极反应式为______________________________
石墨棒C1为______极,电极反应式为_______________________________,检验该产物的简单方法是____________________________________________________
石墨棒C2附近发生的实验现象为____________________________________
(3)当C2极析出224mL气体(标准状态)时,锌的质量减少了______________g。CuSO4溶液的质量增加了_________________________g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com