
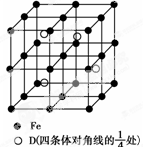
 A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.| m |
| V |
 ,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
,碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体; ;分子;共价键;SiO2;
;分子;共价键;SiO2;| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 139 |
| NA |
4×
| ||
| a3×10-21 cm3 |
| 5.56×1023 |
| a3NA |
| 5.56×1023 |
| a3NA |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
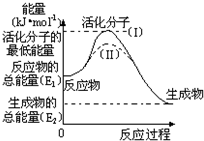 在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.认真观察如图,然后回答问题.
在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.认真观察如图,然后回答问题.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b的活动性一定在氢之后 |
| B、若a与b相连,则a为原电池的正极 |
| C、若c与b相连,则b极上发生氧化反应 |
| D、若将稀H2SO4换为NaOH溶液,a、c分别为镁、铝,则a极上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、nCH2=CH2
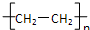 | ||
B、CH2=CH2+HCl
| ||
C、C6H12O6
| ||
D、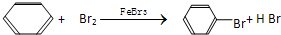 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、CO32-、Cl-、AlO2- |
| B、H+、Fe3+、NO3-、S2- |
| C、Al3+、K+、S2-、SO42- |
| D、NH4+、NO3-、SiO32-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com