
按要求完成下列问题。
(1)写出NH3的电子式: 。 (2) 写出基态Cr原子的简化电子排布式 :_______。
(3)写出基态 Mg2+的电子排布图: 。 (4) 写出Zn原子的价电子排布式 :____________。
(5)将Al、Si、P、S的第一电离能由小到大排列为 。
(6) 指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气后都首先发生置换反应
B.XCl3的溶液能与铜片发生反应,则铜的金属性一定比X强
C.非金属X能将Fe氧化到+3价,但非金属Y不能,则Y的氧化性一定比X强
D.Cl2和SO2等体积充分混合后,通入品红溶液,溶液颜色没有明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
实验题(14分):
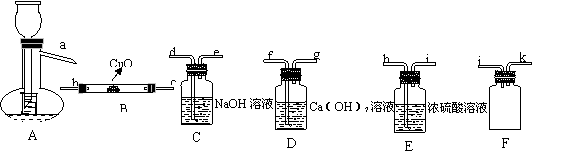 Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照:
Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照: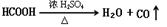 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
(1)若所制气体流向从左向右时,上述仪器连接为:
A→( ) →( )→( )→( ) →( )
(2)A装置中小试管的作用(至少答两条):
① 。② 。
(3)证明HCOOH受热产物中有CO的现象为: 。
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在 处.
Ⅱ、学习小组查阅资料知:
①Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色。
 |
②4CuO 2 Cu2O + O2↑ ③ Cu2O +2H+=Cu + Cu2+ + H2O 因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化。
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化。
(5)写出Cu2O与稀硝酸反应的化学方程式: 。
(6)请你评价方案②的合理性,并简述理由:
方案②: ,理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.凡是中心原子采取sp3杂化的 分子,其立体构形
分子,其立体构形 都是正四面体
都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① [Ne]3s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.最高正化合价:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.第一电离能:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 含有非极性键的分子不一定是共价化合物。
B. 分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响。
C. 根据π键的成键特征判断C=C键能是C—C键能的2倍。
D. H2O中心原子采取sp杂化。
查看答案和解析>>
科目:高中化学 来源: 题型:
请完成下面两个小题:
Ⅰ.(11分)月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1) 3He是高效核能原料,其原子核内中子数为___________。
(2)Na的原子结构示意图为_______,Na在氧气中完全燃烧所得产物的电子式为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点__________(填“高”或”低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,SiO2的晶体类型为_________;所含化学键类型为 。
③MgO与碳粉和足量氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐有___________________ (写化学式)。
Ⅱ.(13分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d 轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________________;Z所在周期中第一电离能最大的主族元素是_________。
 (2) XY2- 离子的立体构型是_____________:R2+的水合离子中,提供孤电子对的原子是________。
(2) XY2- 离子的立体构型是_____________:R2+的水合离子中,提供孤电子对的原子是________。
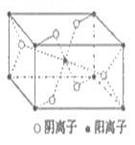
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数比是__________。
(4)将R的硫酸盐溶液中通入足量氨气,充分反应后溶液呈
深蓝色,该反应的离子方程式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬烯是一种食用香料,其结构简式如右图。有关柠檬烯的分析正确的是
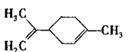
A.它的一氯代物有6种
B.它和丁基苯( 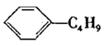 )互为同分异构体
)互为同分异构体
C.一定条件下,它分别可以发生加成、取代、氧化等反应
D.它的分子中所有的碳原子一定在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述正确的是
A.贝诺酯分子中有三种含氧官能团
B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D.贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com