
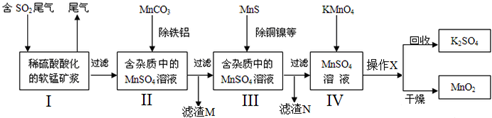
���� ������������������̷�Ӧ���������̣���MnCO3�ܳ�ȥ��Һ��Al3+��Fe3+��MnS��ͭ�������ӻ�ԭΪ���ʣ�����������������̷�Ӧ���ɶ������̣�ͨ�����˻�ö������̣�
��1��SO2���γ����꣬�������ʵ���˷�������ۺ����ã�ͬʱҲ�����������γɣ�
��2������I������ˮMnSO4�ķ�ӦΪ�������̺Ͷ�����������Ӧ���ɣ�����IV������ˮMnO2�ķ�Ӧ�Ǹ��������ˮ��Һ������������Ϊ�������̣�
��3����������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ��Ƕȷ������������������������������Ϊ��������������������ͭ���ӻ�����������ɸ����ܵ���ͭ��
��4��������������ʧ���ӷ���������Ӧ��
��5��SO2+MnO2=MnSO4�����ݷ���ʽ���Ԫ���غ���⣮
��� �⣺������������������̷�Ӧ���������̣���MnCO3�ܳ�ȥ��Һ��Al3+��Fe3+��MnS��ͭ�������ӻ�ԭΪ���ʣ�����������������̷�Ӧ���ɶ������̣�ͨ�����˻�ö������̣�
��1����ɫ��Ⱦ��Ҫ�����ϵ��ѽ���������γɵģ�SO2���γ����꣬�������ʵ���˷�������ۺ����ã�ͬʱҲ�����������γɣ�����ac��ȷ��
�ʴ�Ϊ��ac��
��2������I������ˮMnSO4�ķ�ӦΪ�������̺Ͷ�����������Ӧ���ɣ���Ӧ�Ļ�ѧ����ʽΪ��MnO2+SO2=MnSO4������IV������ˮMnO2�ķ�Ӧ�Ǹ��������ˮ��Һ������������Ϊ�������̣���Ӧ�Ļ�ѧ����ʽΪ��2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2+2H2SO4��
�ʴ�Ϊ��MnO2+SO2=MnSO4��2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2+2H2SO4��
��3����3������̼������������Һ�е��ᣬ������Һ�����ԣ��Ӷ��ٽ�Al3+��Fe3+ˮ���������������������������Ϊ��������������������ͭ���ӻ�����������ɸ����ܵ���ͭ��
�ʴ�Ϊ��������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ�������������������Al��OH��3��Fe��OH��3��CuS��
��4��������������ʧ���ӣ�Mn2++2H2O-2e-=MnO2+4H+����MnO2�����������ɣ��ʴ�Ϊ��������
��5����Ӧ�Ķ�����������ʵ���Ϊ $\frac{2.0��1000}{22.4}$��60%��89.6%=48mol��
����SO2+MnO2=MnSO4��֪���������̵����ʵ���Ϊ48mol���������ɵĶ�������Ϊ10.44kg�������������̵����ʵ���Ϊx��
2KMnO4+3MnSO4+2H2O�T5MnO2+2H2SO4+K2SO4
3 87��5
x 10440g
x=72mol
��ȥ��������ͭ����������ʱ�����������Ԫ�أ�72mol-48mol��=24mol��
�൱��MnԪ�ص�����=24mol��55g/mol=1320g=1.32kg��
�ʴ�Ϊ��1.32��
���� ����ͨ���������̵��Ʊ������������ʵķ��롢�ᴿ���������ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ�Ʊ�ԭ��Ϊ���ؼ���ע�����ջ�ѧʵ������������������ʵķ��롢�ᴿ������������������ѧ���ķ�����������������ѧʵ��������


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д� Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ÿ����55 g K2Sת�Ƶ�����Ϊ6.02��1023 | |
| B�� | S��KNO3��Ϊ��ԭ�� | |
| C�� | ��Ӧ�����е�Ԫ�ر���ԭ | |
| D�� | CO2Ϊ��ԭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��Ӧ����ܼ��ܸ�����������ܼ��� | |
| B�� | ����a��ʹ���˴����������仯���� | |
| C�� | �Ȼ�ѧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����H=-91kJ•mol-1 | |
| D�� | CO��g��+2H2��g��?CH3OH��1����g����H��-91kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| ��������/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ������ | Fe��OH��3 | Al��OH��3 | Cu��OH��2 |
| ��ʼ���� | 1.1 | 4.0 | 5.4 |
| ��ȫ���� | 3.2 | 5.2 | 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��д���䵥�ʵ�һ����Ҫ��;�����뵼����ϣ�������̫���ܵ�ذ�����������оƬ����
��д���䵥�ʵ�һ����Ҫ��;�����뵼����ϣ�������̫���ܵ�ذ�����������оƬ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4�ǰ����ķ���ʽ | B�� |  ��Cl-�Ľṹʾ��ͼ ��Cl-�Ľṹʾ��ͼ | ||
| C�� | C2H4����ϩ�Ľṹ��ʽ | D�� |  ���Ȼ��Ƶĵ���ʽ ���Ȼ��Ƶĵ���ʽ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com