
在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法中错误的是( )
| 物 质 | 氧 气 | 二氧化碳 | 水蒸气 | W |
| 反应前质量/g[ | 50 | 3 | 2 | 23 |
| 反应后质量/g | 2 | 47 | 29 | x |
C
解析试题分析:根据质量守恒定律:50+3+2+23=2+47+29+x,则x=0,则可知反应物为:氧气、W;生成物为二氧化碳与水蒸气.二氧化碳中的碳元素的质量为47×12/44×100%=12.8克,水中的氢元素的质量为29×2/18×100%=3.2克,12.8+3.2=16克小于23克,故W含有碳、氢、氧元素。C、物质W只含碳和氢两种元素,说法错误,因为W含有碳、氢、氧元素,故C错误;D、物质W可能含碳、氢、氧三种元素,说法正确,故D正确;A、根据质量守恒定律,x的值为0,说法正确,故A正确;D、反应后的生成物是二氧化碳和水,说法正确,故D正确。故选C。
考点:本题考查质量守恒定律的内容:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。


科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.在标准状况下,1mol水的体积是22.4 L |
| B.1mol H2所占的体积一定是22.4L |
| C.1 L0.5 mol·L-1的 MgCl2溶液中,含有Cl-的个数为0.5NA(NA为阿伏加德罗常数) |
| D.在标准状况下,总质量为28 g的N2和CO的混合气体,其体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有CuO、FeO、Fe2O3组成的混合物m g,向其中加入100mL 1mol·L-1硫酸,恰好完全溶解,若m g该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为 ( )
| A.(m-0.8)g | B.(m-1.2)g | C.(m-1.6)g | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学用语正确的是
| A.乙烯的结构简式:CH2CH2 |
B.氟原子的结构示意图: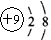 |
C.甲烷的电子式: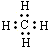 |
| D.碳酸钠的电离方程式:Na2CO3=Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,2.24 L SO3所含分子数目为0.1NA |
| B.6.0gSiO2中含氧分子的数目为0.1NA |
| C.78g Na2O2固体中含Na+离子的数目为NA |
| D.2.3gNa完全燃烧后失去电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.11.2 L氧气中所含有的原子数为NA |
| B.同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 |
| C.物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA |
| D.54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是( )
| A.1.00 mol NaCl中含有6.02×1023个NaCl分子 |
| B.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设阿伏加德罗常数的数值用NA表示,下列叙述中正确的是( )
①在反应KIO3+6HI KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
②35.5 g Cl2中含有共价键数为NA
③0.44 g C3H8中含有的共价键总数目为0.1NA
④24 g镁的原子中最外层电子数为NA
⑤6.4 g的S2和S8混合物中,含硫原子总数为0.2NA
⑥在常温常压下,1 mol甲烷分子所含质子数为10NA
⑦1 mol冰醋酸与1 mol乙醇在加热和浓硫酸存在条件下充分反应生成的水分子数为NA
| A.③⑤⑥ | B.②③④⑤ | C.②④⑥⑦ | D.①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com