
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有些活泼金属,如铝可作还原剂法的还原剂 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(酸)=102 V(碱) | B. | V(碱)=102 V(酸) | C. | V(酸)=2 V(碱) | D. | V(碱)=2 V(酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7 | B. | 2.0 | C. | 12.0 | D. | 12.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
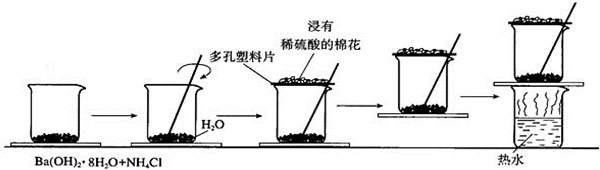
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 生成白色沉淀 |

| 实验步骤、预期现象和结论(不要求写具体操作过程): |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com