
| A. |  具支试管 | B. | 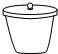 坩锅 | C. | 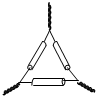 三角架 | D. |  圆底烧瓶 |
科目:高中化学 来源: 题型:选择题
| A. | 分子中的C、H、O的个数比为1:2:n(n为正整数) | |
| B. | 分子中C、H个数比为1:2 | |
| C. | 该有机物可能为苯的同系物 | |
| D. | 该分子中肯定不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
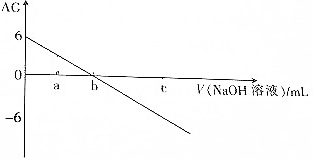
| A. | 若a点加入NaOH溶液的体积为10mL,则溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | b点加入NaOH溶液的体积为20mL | |
| C. | b点时,溶液中存在:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 若c点加入NaOH溶液的体积为40mL,则溶液中:c(CH3COO-)+2c(CH3C00H)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O含电子数目为10NA | |
| B. | 标准状况下,NA个HF分子所占的何种约为22.4L | |
| C. | 4.5g SiO2晶体中含有的硅氧键的数目为0.3NA | |
| D. | 常温下将0.1mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过加热鉴别Na2CO3和NaHCO3 | B. | 通过加水溶解鉴别Na2O和Na2O2 | ||
| C. | 通过焰色反应鉴别NaCl和KCl | D. | 通过纸上层析法鉴别CuCl2和FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的NaHSO4溶液,PH=1 | B. | 0.1mol/L的H2SO4溶液,PH>1 | ||
| C. | 0.01mol/L的NaOH溶液,PH=10 | D. | pH=9的NaOH溶液稀释1000倍,PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12 L CO2气体通入1 L 0.1 mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L 的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com