
| A. | ①② | B. | ②④ | C. | ①③ | D. | ①④ |
分析 依据化学平衡三段式列式计算各组分平衡时物质的量,同温同压下,密度之比和气体体积成反比,即和气体物质的量成反比,据此结合选项讨论判断a、b的取值,以此解答该题.
解答 解:1mol X气体跟a mol Y气体在体积可变的密闭容器中反应,反应达到平衡后,测得X的转化率为50%,则参加反应的X为0.5mol,则:
X(g)+a Y(g)?b Z(g)
起始量(mol):1 a 0
变化量(mol):0.5 0.5a 0.5b
平衡量(mol):0.5 0.5a 0.5b
同温同压下,气体总质量不变,反应前后混合气体的密度之比和气体体积成反比,即和气体物质的量成反比,反应前混合气体的密度是反应后混合气体密度的$\frac{3}{4}$,则反应前气体物质的量是反应后气体物质的量$\frac{4}{3}$,则(1+a):(0.5+0.5a+0.5b)=4:3,整理得:2b=a+1,
若a=1,则b=1,若a=2,则b=1.5,若a=3,则b=2,
故选D.
点评 本题考查了化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确同温同压下混合气体密度之比和气体物质的量成反比是计算关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
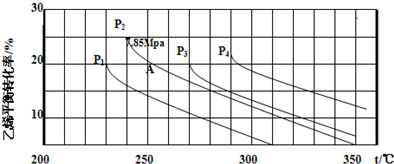
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com