
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题。

(1)写出装置A中所发生反应的离子方程式___________。
(2) B中最适宜的试剂是___________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:_________。
(4)装置D中黑色固体为________(填名称),反应的化学方程式为________________。
(5)按照如图装置进行实验时,首先进行的操作是_______________________。
(6)根据实验中的_________现象,可证明CO具有还原性,有关反应的化学方程式是________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置___与_____之间连接下图中的________装置(填序号)。
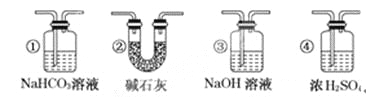
【答案】CaCO3+2H+=Ca2++H2O+CO2↑ 饱和碳酸氢钠溶液 没有除去气体中的水蒸气,高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO 碳 C+CO2![]() 2CO 检验装置的气密性 E装置中黑色CuO变成红色 CuO+CO
2CO 检验装置的气密性 E装置中黑色CuO变成红色 CuO+CO![]() Cu+CO2 D E ②
Cu+CO2 D E ②
【解析】
(1)根据A中的试剂可知,A是制取CO2的,所以方程式为CaCO3+2H+=Ca2++H2O+CO2↑;
(2)由于盐酸易挥发,所以生成的CO2中含有氯化氢以及水蒸气,所以B中应该盛放的是饱和碳酸氢钠溶液,用来除去氯化氢;
(3)由于高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO,如果没有干燥CO2,则无法验证与氧化铜反应的氢气还是CO;
(4)高温下,碳能和CO2反应生成CO,所以方程式为C+CO2![]() 2CO;
2CO;
(5)装置图连接好以后,首先要检验装置的气密性;
(6)CO还原氧化铜生成单质铜,所以如果E装置中黑色CuO变成红色,即能证明CO具有还原性,反应的方程式为CuO+CO![]() Cu+CO2;
Cu+CO2;
(7)由于碳和CO2反应时CO2是过量的,所以应该再D和E之间连接一个除去CO2、且不能引入其它杂质的装置,所以选择碱石灰,即答案选②。
(1)由实验装置图可知,A中用盐酸和石灰石反应制取二氧化碳,盐酸和石灰石反应生成氯化钙、二氧化碳和水,反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(2)盐酸和石灰石反应放出的热量导致盐酸挥发,制取的二氧化碳中含有氯化氢气体和水蒸气,应选用饱和碳酸氢钠溶液除去二氧化碳中混有的氯化氢,故答案为:饱和碳酸氢钠溶液;
(3)浓硫酸具有吸水性,能干燥二氧化碳;若实验中没有装置C,从B装置出来的气体中含有水蒸气,碳和水蒸气反应生成的氢气也能还原氧化铜,干扰一氧化碳具有还原性的验证,故答案为:没有除去气体中的水蒸气,高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO;
(4)高温条件下,二氧化碳和碳反应生成一氧化碳,则D装置中的黑色固体是碳,反应的化学方程式为C+CO2![]() 2CO,故答案为:碳;C+CO2
2CO,故答案为:碳;C+CO2![]() 2CO;
2CO;
(5)在做与气体有关的实验操作时,连接完仪器以后,加药品前,首先要检验装置的气密性,以免装置气密性不好,影响实验进行,故答案为:检查装置的气密性;
(6)一氧化碳具有还原性,高温下能还原黑色的氧化铜,使其变为红色的铜单质,则E中的实验现象为黑色固体变为红色,反应方程式为CuO+CO![]() Cu+CO2,故答案为:E装置中黑色CuO变成红色;CuO+CO
Cu+CO2,故答案为:E装置中黑色CuO变成红色;CuO+CO![]() Cu+CO2;
Cu+CO2;
(7)由于碳和二氧化碳的反应中,二氧化碳不可能完全转化为一氧化碳,所以从D装置出来的气体中含有二氧化碳,为防止原来二氧化碳的干扰,应先把D出来的二氧化碳除去,再将一氧化碳气体通过E装置,二氧化碳是酸性氧化物,所以用碱性物质除去,所以选②,故答案为:D;E;②。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是
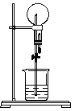
A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是
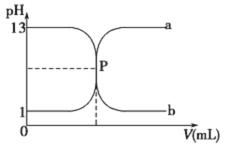
A. 滴定过程的任何时刻都存在:c(H+)+ c(Na+)=c(OH-)+c(Cl-)
B. 曲线b是用氢氧化钠溶液滴定盐酸溶液的滴定曲线
C. 氢氧化钠溶液的物质的量浓度为0.1molL-1
D. P点时恰好完全中和,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)![]() C(g)+D(g),下列描述中不能表明该反应已达到平衡状态的是
C(g)+D(g),下列描述中不能表明该反应已达到平衡状态的是
A.混合气体的密度不变B.单位时间内生成nmolD,同时生成nmolC
C.容器中的温度不再变化D.C(g)的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应:3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是

A. 若t1=15s, A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.09 mol·L-1·s-1
B. t0~t1阶段,此过程中容器放出a kJ热量,该反应的热化学方程式为:3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
C. 该容器的容积为2 L,B的起始的物质的量为0.03 mol
D. t1时该反应达到平衡且A 的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在400℃、101 kPa时,NO2(g) +CO(g) ![]() NO(g) + CO2(g) 反应过程的能量变化如下图所示。
NO(g) + CO2(g) 反应过程的能量变化如下图所示。
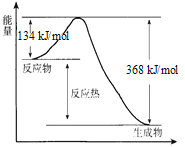
反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种化合物,它们分别由下列五种原子团的两种不同的基团组成,这五种基团是-CH3,-C6H5,-OH,![]() ,
,![]() 。
。
已知:(1) A是无色晶体,有特殊气味,在空气中易氧化成粉红色;
(2) B、C能发生银镜反应,C的分子量大于B;
(3) D的水溶液与少量氢氧化钠溶液反应,生成-1价的阴离子;与过量氢氧化钠溶液反应,生成-2价阴离子。D可以和A的钠盐反应生成A;
(4) E可以由B氧化制取;
(5) F能氧化成饱和一元醛。
根据上述条件,推断其结构简式分别为:
A____________________B_____________________C_______________
D__________________E_____________________F________________。
上述A、D、E的酸性由强到弱的顺序是_____________________________(用化学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com