
【题目】根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10﹣3 | 2.55×10﹣2 | 9×10﹣4 | 1.1×10﹣2 |
下列说法不正确的是( )
A.硫酸钙悬浊液中存在CaSO4(s)Ca2+(aq)+SO42﹣(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3 , 沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
【答案】D
【解析】解:A、硫酸钙悬浊液是硫酸钙的饱和溶液,存在溶解平衡,其溶解平衡的表达式为:CaSO4(s)Ca2+(aq)+SO42﹣(aq),故A正确;
B、根据Ksp可知,CaSO4的溶解度大于CaCO3的溶解度,而沉淀容易由溶解度大的向溶解度小的转化,故用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3,故B正确;
C、沉淀容易由溶解度大的向溶解度小的转化,向Mg(OH)2悬浊液中滴加FeCl3,沉淀变为红褐色,即Mg(OH)2转化为Fe(OH)3沉淀,则说明溶解度Fe(OH)3<Mg(OH)2,故C正确;
D、设产生MgCO3沉淀时所需的碳酸根的浓度为c(CO32﹣),产生Mg(OH)2沉淀是所需的氢氧根的浓度为c(OH﹣),根据MgCO3的Ksp可知:c(Mg2+)c(CO32﹣)=,根据Mg(OH)2的Ksp可知:c(Mg2+)c(OH﹣)2=9×10﹣4,即当同时产生MgCO3和Mg(OH)2沉淀时,所需的碳酸根和氢氧根的浓度之比为: ![]() =
= ![]() ,则
,则 ![]() =
= ![]() ,
, ![]() =
= ![]() =1.1:3,故产生Mg(OH)2沉淀所需的氢氧根的浓度比产生MgCO3沉淀所需的碳酸根的浓度更高,故应先产生产生MgCO3沉淀,故D错误.
=1.1:3,故产生Mg(OH)2沉淀所需的氢氧根的浓度比产生MgCO3沉淀所需的碳酸根的浓度更高,故应先产生产生MgCO3沉淀,故D错误.
故选D.
A、硫酸钙悬浊液是硫酸钙的饱和溶液,存在溶解平衡;
B、CaSO4的溶解度大于CaCO3的溶解度;
C、沉淀容易由溶解度大的向溶解度小的转化;
D、根据MgCO3和Mg(OH)2的Ksp来计算.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】自然界中存在大量元素,在工农业生产中有广泛应用。回答下列问题:
(1)人工合成的蓝宝石晶体(Al2O3)是目前半导体工业中应用最广泛的材料。
①基态Al原子中有______种运动状态不同的电子,核外电子占据最高能级的符号是_____,占据该能级电子的电子云轮廓图形状为_______。
②比较第一电高能:Mg______Al(填“>”、”<”或“=”)。在现代化学中,常利用_________上的特征谱线来鉴定元素,称为光谱分析。
(2)羰基硫(COS)存在于许多种植物中,杀虫效果显著。
①1molCOS分子中含有σ键的数目为_____,其中心原子的杂化方式为_____。
②CS2、CO2、COS的分解温度由低到高的顺序为_____。
(3)NaCl 和MgO都属于离子化合物.NaC1的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________。
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
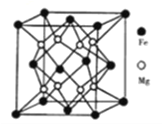
则:①距离一个Fe原子最近的Mg原子个数是______,与此晶胞结构相似的常见的离子晶体是______(填名称)。
②若该晶体储氢时,H2 分子在晶胞的体心和棱心位置,晶胞的参数为dnm,則距离最近的两个H2分子之间的距离为______cm;含铁56g的该储氢合金可储存标准状况下H2 的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种溶液:①醋酸溶液,②盐酸.下列说法错误的是( )
A.两溶液中水电离出的c(H+):①=②
B.两溶液分别加水稀释10倍,稀释后溶液的pH:②>①
C.取大小和形状完全相同的两块锌粒分别投入两种酸中,当产生相同体积的气体时所需的时间:①>②
D.等体积的两溶液分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( ) 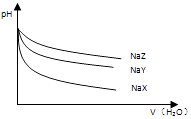
A.在上述三种盐原溶液中,水的电离程度大小是NaX>NaY>NaZ
B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z﹣)>c(Y﹣)>c(X﹣)
C.在上述NaX和NaY的混合液中存在 ![]() =
= ![]()
D.在0.2molL﹣1 NaX溶液中加 入等体积0.1molL﹣1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH﹣)+c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均是原子序数小于36的元素.A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2. 根据信息回答下列问题:
(1)C的外围电子排布图为 . C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为
(2)用电子式表示化合物AE2的形成过程
(3)F与BD易形成配合物F(BD)5 , 在F(BD)5中F的化合价为
(4)E有多种含氧酸根①EO﹣②EO2﹣③EO3﹣④EO4﹣ , 其中空间构型为四面体形的是(填序号).
(5)C 的最高价氧化物对应的水化物与A 的单质反应时,C被还原到最低价,该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx , 形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)SO2分子的空间构型为 .
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10﹣3molL﹣1 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子 | SO42﹣ | SO32﹣ | NO3﹣ | NO2﹣ | Cl﹣ |
c/(molL﹣1) | 8.35×10﹣4 | 6.87×10﹣6 | 1.5×10﹣4 | 1.2×10﹣5 | 3.4×10﹣3 |
①写出NaClO2溶液脱硫过程中主要反应的离子方程式 . 增加压强,SO2的转化率(填“提高”“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐 (填“提高”“不变”或“降低”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是 .
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压Pa如图所示. 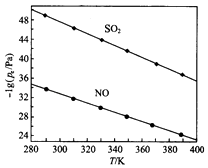
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”“不变”或“减小”).
②反应ClO2﹣+2SO32﹣=2SO42﹣+Cl﹣的平衡常数K表达式为
(4)如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种物质:①乙酸 ②苯 ③聚乙烯 ④苯酚 ⑤2-丁炔 ⑥甲醛 ⑦邻二甲苯 ⑧环己烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是
A. ①③④⑤⑧ B. ②④⑤⑦⑧ C. ④⑤⑥⑧ D. ③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的燃烧热ΔH=-890.3 kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com