
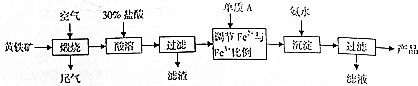
| 温度/℃ | 产品颜色 |
| 35 | 灰色 |
| 40 | 灰黑 |
| 60 | 黑色 |
| 65 | 红黑 |
| 80 | 黑褐 |
分析 (1)氧化还原反应中元素化合价升高的元素被氧化,对应的反应物为还原剂,反之为氧化剂,被还原,4FeS2+11O2=2Fe2O3+8SO2中,Fe、S元素的化合价升高,O元素的化合价降低,根据转移的电子数与二氧化硫的关系计算转移的电子数;
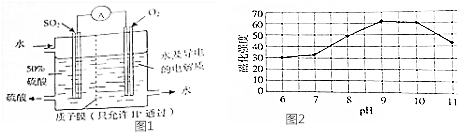
(2)装如图1中,通入二氧化硫的电极失电子发生氧化反应,为负极;
(3)Fe2+和Fe3+易水解,水解呈酸性,加入过量盐酸是抑制亚铁离子、铁离子的水解,酸溶还可以提高浸出率;
(4)氯气是强氧化剂,可以氧化亚铁离子;n(Fe2+)/n(Fe3+)偏高,通入氯气氧化亚铁离子,偏低加入铁粉还原铁离子;
(5)Fe2+和Fe3+与氨水反应生成沉淀,过滤洗涤得到四氧化三铁,所以沉淀为四氧化三铁,据此书写离子反应方程式;
(6)根据产品的颜色选择实际生产需控制的温度,根据图表磁化强度与PH的关系分析采取的措施,Fe2+具有还原性,Fe3+具有氧化性,需通入保护气防止分别被氧化、还原.
解答 解:(1)反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,反应中氧气中氧元素化合价从0价变化为-2价;氧元素被还原,铁元素化合价从+2价变化为+3价,硫元素化合价从-1价变化为+4价,FeS2作还原剂,硫元素和铁元素被氧化,4molFeS2参加反应转移44mol电子,生成8molSO2,当有1molSO2生成时,转移的电子数为:$\frac{44}{8}$=5.5mol,
故答案为:5.5;
(2)装如图1中,该电极上二氧化硫失电子和水反应生成硫酸,所以该电极为负极,发生氧化反应,电极反应式为SO2-2e+2H2O=SO42-+4H+,
故答案为:SO2-2e+2H2O=SO42-+4H+;
(3)煅烧后的矿渣酸溶后含有Fe2+和Fe3+,Fe2+和Fe3+易水解,水解呈酸性,酸溶时需保持盐酸过量,能抑制亚铁离子、铁离子的水解,同时过量的酸溶还可以提高浸出率,
故答案为:抑制Fe2+和Fe3+水解以及提高浸出率;
(4)酸溶时加入盐酸,引入氯离子,在调节比例前检测发现n(Fe2+)/n(Fe3+)偏高,需通氯气氧化,氯气氧化亚铁离子为铁离子,发生的主要反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;若比例偏低,需将铁离子还原成亚铁离子,需加铁粉,反应为:Fe+2Fe3+=3Fe2+,
故答案为:Cl2,Fe;
(5)根据题干信息,Fe2+和Fe3+与氨水反应生成沉淀,过滤洗涤得到四氧化三铁,所以沉淀为四氧化三铁,反应的离子方程式为:Fe2++2Fe3++8NH3•H2O=Fe3O4↓+8NH4++4H2O,
故答案为:Fe2++2Fe3++8NH3•H2O=Fe3O4↓+8NH4++4H2O;
(6)四氧化三铁俗名为磁性氧化铁,颜色为黑色,所以实际生产中需控制温度为60℃,从图2中数据可知,当PH=9时,产品磁化强度最高,所以控制溶液的H=9,Fe2+具有还原性,Fe3+具有氧化性,所以持续往体系通入氮气作保护气,
故答案为:持续往体系通入氮气,控制温度在60℃和溶液的PH为9.
点评 本题考查磁性纳米四氧化三铁实验制备方案设计,为高频考点,涉及盐类水解、氧化还原反应等知识点,熟悉图中信息及基本操作方法、明确反应原理及物质性质是解本题关键,题目难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的分离提纯方法之一为“筛分”,如:胶体--渗析法提纯,浊液--过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒和滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 工业上电解饱和食盐水时,为了阻止产物相互之间反应,往往用阴离子交换膜把阳极和阴极隔开 | |
| D. | 室温下,浓度均为0.1 mol•L-1Na2S2O3和H2SO4溶液,各取5 mL、10 mL的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,可验证Na2S2O3浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 序号 | 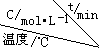 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
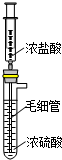 实验室用如图装置制备HCl气体.
实验室用如图装置制备HCl气体.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
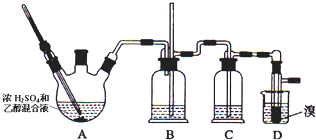
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| B. | 新制氯水久置后变为无色 | |
| C. | 单质硅是光导纤维的主要成分 | |
| D. | 普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com