
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
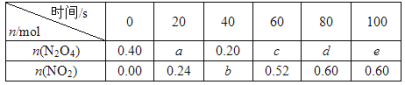
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
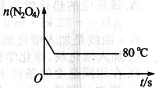
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
【答案】(1)0.002 0 (2)1.8 mol L1 (3)变浅
(4)D
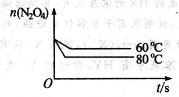
(5)如下图:
【解析】(1)20 s时,n(N2O4) =0.40 mol ![]() ×0.24 mol = 0.28 mol。
×0.24 mol = 0.28 mol。
v(N2O4)=![]() = 0.002 0 mol/(Ls)。
= 0.002 0 mol/(Ls)。
(2)反应进行到80 s时达到平衡状态,d = 0.40 mol![]() ×0.60 mol = 0.10 mol。
×0.60 mol = 0.10 mol。
K=![]() =
=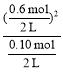 =1.8 molL1
=1.8 molL1
(3)降低温度,反应逆向进行,混合气体颜色变浅。
(4)K只是温度的函数,与反应物和生成物的浓度、催化剂无关。
(5)该反应为吸热反应,温度降低,平衡向逆反应方向移动,N2O4的平衡浓度增大,且到达平衡状态需要的时间更长,据此即可画出N2O4的变化曲线。


科目:高中化学 来源: 题型:
【题目】根据下列的有机物合成路线回答问题: 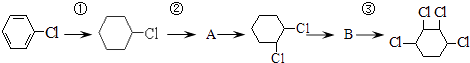
(1)写出A、B的结构简式:A、B .
(2)写出各步反应类型:①②③ .
(3)写出②、③的反应方程式: ② ,
③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
A.K+、OH﹣、Cl﹣、SO42﹣
B.H+、NH4+、Al3+、NO3﹣
C.Na+、S2﹣、Cl﹣、SO42﹣
D.Na+、C6H5O﹣、CH3COO﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中:①Na ②Na2O固体③CO2④ FeCl3溶液 ⑤蔗糖溶液 ⑥熔融MgSO4(请用序号填空).
属于氧化物的是________, 属于电解质的是________,能导电的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述正确的是
A.H2还原CuO的反应只属于还原反应
B.置换反应都是氧化还原反应,所以,3CO+Fe2O3![]() 2Fe+3CO2既是置换反应又是氧化还原反应
2Fe+3CO2既是置换反应又是氧化还原反应
C.3O2![]() 2O3是氧化还原反应
2O3是氧化还原反应
D.复分解反应一定不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 .
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢溶液可作为采矿业废液消毒剂,如消除采矿废液中剧毒的氰化钾,反应方程式为KCN+H2O2+H2O![]() A+NH3↑(已配平),请回答:(提示:
A+NH3↑(已配平),请回答:(提示:![]() 、
、![]() )
)
(1)生成物A的化学式是_____________________________。
(2)该反应是否是氧化还原反应?________(填写“是”或“否”),其理由是_____________________。若是,则被还原的元素是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是乙醇燃料电池的实验装置图,下列有关说法一定正确的是( ) 
A.若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极
B.甲池中负极的电极反应式为:CH3CH2OH﹣12e﹣+3H2O=2CO2+12H+
C.甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.04g
D.M电极上的电极反应式为:Ag++e﹣=Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com