
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是_____________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-) b.NH4+水解是微弱的
c.NH3·H2O是弱碱 d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(5)某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是____,

A.a点导电能力比b点强
B.b点的KW值大于c点
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.a、c两点c(H+)相等
【答案】< NH4++H2O![]() NH3·H2O+H+ 相同 BabcD
NH3·H2O+H+ 相同 BabcD
【解析】
(1)25℃时,0.1molL-1②NH4Cl 溶液中铵根离子水解溶液显酸性,溶液的pH<7,反应的离子方程式为:NH4++H2ONH3H2O+H+,故答案为:<;NH4++H2ONH3H2O+H+;
(2)浓度均为0.1mol/L的③Na2CO3中存在碳酸根离子的2步水解,⑥NaHCO3的溶液中存在水解和电离,两溶液中都存在水的电离,因此离子种类相同,分别含:Na+、CO32-、HCO3-、H+、OH-,故答案为:相同;
(3)A.CH3COOH溶液加水稀释,浓度减小,c(H+)减小,故A不选;B.CH3COOH溶液加水稀释,促进醋酸的电离,氢离子的物质的量增大,醋酸分子的物质的量减小,c(H+)/c(CH3COOH)比值变大,故B选;C.稀释过程,溶液的温度不变,c(H+)c(OH-)=Kw,Kw不变,故C不选,故答案为:B。
(4)室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12,即溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O为弱碱。a、溶液的pH=5.12,即溶液显酸性,故溶液中c(H+)>c(OH-),故a正确;b、NH3H2O为弱碱,故NH4+是弱碱阳离子,在水溶液中能水解,且水解程度很小,故b正确;c、溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O为弱碱,故c正确;d、NH4Cl为强酸弱碱盐,在水溶液中能水解,而盐的水解能促进水的电离,故此溶液中由H2O电离出的c(H+)>10-7mol/L,故d错误;e、物质的量浓度相等的氨水和盐酸等体积混合,会恰好完全反应得NH4Cl溶液,但由于NH4Cl为强酸弱碱盐,水解显酸性,故溶液的pH<7,故e错误;故选abc;
(5)根据信息可知氢氧化钠溶液和氨水具有相同的体积和pH,由于氢氧化钠是强电解质,一水合氨是弱电解质,则氢氧化钠的浓度小于氨水,稀释过程中,促进一水合氨电离,所以pH变化快的是氢氧化钠,变化慢的是氨水,即a为氢氧化钠,b或c为氨水。A.溶液的导电能力与离子浓度成正比,a点的离子浓度小于b点,所以a点溶液的导电能力比b点溶液的导电能力弱,故A错误;B.电离平衡常数只与温度有关,温度不变,则电离平衡常数不变,即bc电离平衡常数相等,故B错误;C.等pH的氨水和氢氧化钠,氨水的浓度大于氢氧化钠,等体积时,氨水的物质的量大于氢氧化钠,碱的物质的量越大消耗同浓度酸的体积越多,故C错误;D.根据图像,a、c两点的pH相等,则c(H+)相等,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.电解得到的Cu的物质的量为0.5mol
B.向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C.原混合溶液中c(K+)=4mol/L
D.电解后溶液中c(H+)=2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,2体积AB2气体和1体积B2气体化合生成2体积气态化合物,则该化合物的化学式为
A. AB3 B. AB2 C. A3B D. A2B3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 食盐溶液静置会分层,上层比下层咸
B. “冰水混合物”是一种分散系
C. 黄河入海口处三角洲的形成与胶体性质有关
D. 电泳现象说明胶体带电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol/L的7种溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaHSO4 | NaClO |
pH | 12 | 9.7 | 12.3 | 10.0 | 6.0 | 1.0 | 10.3 |
请由上表数据回答:
(1)上述表中pH=12的Na2CO3溶液中水电离出的氢氧根离子浓度为:______ mol/L
(2)根据表中的数据分析,物质的量浓度均为0.1mol/L的Na2CO3、Na2SiO3、NaHCO3、NaHSO3溶液中水的电离程度最大的是:______________(填化学式)
(3)用适当的语言和化学用语分析NaHSO3溶液显酸性的原因:_____________
(4)用离子方程式说明Na2SO3溶液pH>7的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。

其中图乙、丙、丁三个电池的总电极反应方程式如下:
图乙:Zn+Ag2O+H2O═Zn(OH)2+2Ag
图丙:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+MnO(OH)
图丁:PbO2+Pb+2H2SO4═2PbSO4+2H2O
下列说法不正确的是( )
A. 甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 乙:正极的电极反应式为Ag2O+2e﹣+H2O═2Ag+2OH﹣
C. 丙:锌筒作负极,发生氧化反应,锌筒会变薄
D. 丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:

(1)温度T1____________T2(填大于、等于或小于)。
(2)正反应是_________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m______2(填大于、等于或小于)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填增大、减小或不变),平衡_________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)26H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:FeS2与H2SO4不反应。相应物质的溶解度曲线如下图。
(1)FeS2中S元素的化合价为______。
(2)硫铁矿焙烧的主反应是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
(3)加H2SO4酸浸,发生反应的离子方程式为______。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。反应Ⅰ为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+反应Ⅱ的离子方程式为:______。
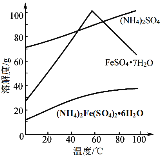
(5)得到莫尔盐晶体的操作是:蒸发浓缩、结晶、过滤、洗涤。结晶、过滤时选择的适宜温度为60℃,解释选择该温度的原因______。
(6)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中,______,证明含有Fe2+和NH4+。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com