
| A. | X与其它元素之间只能形成共价键 | |
| B. | Z元素的最高价氧化物是玻璃的主要成分,其常温下就能与强碱发生反应 | |
| C. | 非金属性Y强于Z | |
| D. | 三种元素中X的原子半径最小 |
分析 有X、Y、Z三种原子序数逐渐增大的主族元素,它们分别处于不同短周期,则X为H元素,Y位于第二周期、Z位于第三周期;Y是自然界中形成化合物种类最多的元素,则Y为C元素;Z元素在地壳中的含量是同周期主族元素中最高的,Z位于第三周期,第三周期中地壳中含量最高的为Si元素,则Z为Si元素,据此结合元素周期律知识解答.
解答 解:有X、Y、Z三种原子序数逐渐增大的主族元素,它们分别处于不同短周期,则X为H元素,Y位于第二周期、Z位于第三周期;Y是自然界中形成化合物种类最多的元素,则Y为C元素;Z元素在地壳中的含量是同周期主族元素中最高的,Z位于第三周期,第三周期中地壳中含量最高的为Si元素,则Z为Si元素,
A.X为H元素,H与金属Na可以形成离子键,故A错误;
B.Z的最高价氧化物为二氧化硅,二氧化硅是玻璃的主要成分,且常温下二氧化硅能与强碱发生反应生成硅酸盐和水,故B正确;
C.Y、Z分别为C、Si元素,二者位于同一主族,原子序数越大非金属性越弱,则非金属性C>Si,故C正确;
D.X为H元素,氢原子是原子半径最小的原子,故D正确;
故选A.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钾与硫酸的反应 | B. | 锌与盐酸反应放出氢气 | ||
| C. | CO2通过炽热的焦炭发生的反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
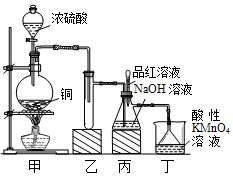 某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如图所示:| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加盐酸. | 若品红褪色(或有气泡),则说明含有Na2SO3. |
| 步骤3:用试管取少量A,向其中加入过量的氢氧化钡溶液或先加入品红再加入盐酸. | 若若生成白色沉淀或品红褪色,则说明有NaHSO3生成; 否则不存在NaHSO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
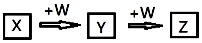 X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )| A. | 若W是强氧化性的单质,则X可能是金属铝 | |
| B. | 若W是氢氧化钠,则X水溶液为酸性 | |
| C. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| D. | 若W是氧气,则X、Z的相对分子质量可能相差48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+)]<c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物能与水反应生成相应的酸 | |
| B. | 室温下,0.05mol•L-1的M的气态氢化物的水溶液的PH>l | |
| C. | 简单离子半径由大到小的顺序:Y>Z>M | |
| D. | Y、Z元素的单质作电极,在NaOH溶液环境下构成原电池,Z电极上产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com