

分析 强酸性溶液中一定不会存在CO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,得到沉淀G为Fe(OH)3,溶液H中通入过量CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,J为NaHCO3,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,强酸性条件下一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此来解答.
解答 解:强酸性溶液中一定不会存在CO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,得到沉淀G为Fe(OH)3,溶液H中通入过量CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,J为NaHCO3,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,强酸性条件下一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-.
(1)由上述分析可知,一定含有Al3+、NH4+、Fe2+、SO42-,不能确定含Fe3+、Cl-,
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-;
(2)反应②的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)Fe(OH)3和次氯酸反应获得高铁酸钾的方程式为:3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O,
故答案为:3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O;
(4)A、F、I均为0.1mol,10mLX溶液中n(H+)=0.4mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知n(Fe2+)=0.3mol,由上述可知n(NH4+)=0.1mol,n(Al3+)=0.1mol,n(BaSO4)=0.8mol,
根据溶液电中性可知:n(H+)+2n(Fe2+)+3n(Al3+)+n(NH4+)=1.4mol<2n(SO42-)=1.6mol,故一定含有Fe3+离子,另外溶液中还可能含有Cl-离子,
故答案为:Fe3+.
点评 本题考查无机物推断、离子共存,题目具有一定难度,侧重考查学生分析推理能力,要紧扣反应现象推断离子存在的可能性,(4)为易错点题,注意溶液电中性的利用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 向Fe(NO3)3溶液中通入足量HI气体:2Fe3++2I-═2Fe2++I2 | |
| C. | 向NaHCO3溶液中滴入少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向水玻璃溶液中通入过量CO2:SiO32-+H2O+CO2═CO32-+H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热分解NH4Cl固体可以制得NH3 | |
| B. | Fe2O3是碱性氧化物,常用作红色油漆和涂料 | |
| C. | 硅单质常用来制作光导纤维和太阳能电池 | |
| D. | 浓硫酸具有脱水性,可以干燥Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 甘油(水):用分液漏斗分离 | |
| C. | 苯(苯酚):加NaOH溶液,充分振荡,分液 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
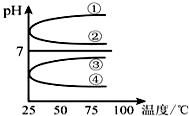 (1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).
(1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Mg能放出H2的溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 存在较多的Fe3+的溶液中:HCO3-、Cl-、SO42- | |
| C. | 水电离产生的c(OH-)=1×10-10 mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| D. | 使甲基橙变红色的溶液中:Na+、AlO2-、NO3-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com