
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和![]() 、NO的混合气体4.48L,这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至
、NO的混合气体4.48L,这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至![]() 恰好完全沉淀,消耗NaOH溶液的体积是60mL.(气体体积均在标准状况下测定,下同)。下列说法不正确的是( )
恰好完全沉淀,消耗NaOH溶液的体积是60mL.(气体体积均在标准状况下测定,下同)。下列说法不正确的是( )
A. 参加反应的硝酸是0.5mol
B. 消耗氧气的体积是1.68L
C. 混合气体中含![]() 3.36L
3.36L
D. 此反应过程中转移的电子为0.6mol
【答案】D
【解析】
标况下4.48LNO2、NO混合气体的物质的量为:n=4.48L÷22.4L/mol=0.2mol, 60mL 5mol/L的氢氧化钠溶液中氢氧化钠的物质的量为:n(NaOH)=5mol/L×0.06L=0.3mol。
A.铜离子恰好沉淀时,反应后的溶质为硝酸钠,根据钠离子守恒可知硝酸钠中硝酸根离子的物质的量为0.02mol,再根据氮原子守恒可得硝酸的物质的量;
B.生成氢氧化铜的物质的量为:0.3mol×![]() =0.15mol,反应消耗的铜的物质的量为0.15mol,0.15mol铜完全反应失去0.3mol电子,根据电子守恒,氧气得到的电子与铜失去的电子一定相等,根据电子守恒计算出消耗氧气物质的量,再计算出其体积;
=0.15mol,反应消耗的铜的物质的量为0.15mol,0.15mol铜完全反应失去0.3mol电子,根据电子守恒,氧气得到的电子与铜失去的电子一定相等,根据电子守恒计算出消耗氧气物质的量,再计算出其体积;
C.设NO的物质的量为x、二氧化氮的物质的量为y,分别根据总体积、电子守恒列式计算;
D.根据B的分析可知反应转移的电子的物质的量。
标况下4.48LNO2、NO混合气体的物质的量为:n=4.48L÷22.4L/mol=0.2mol;60mL 5mol/L的氢氧化钠溶液中氢氧化钠的物质的量为:n(NaOH)=5mol/L×0.06L=0.3mol。
A.铜离子恰好沉淀时,反应后的溶质为硝酸钠,根据钠离子守恒可知硝酸钠中硝酸根离子的物质的量为0.3mol,根据氮原子守恒可得硝酸的物质的量为:0.3mol+0.2mol=0.5mol,A正确;
B.生成氢氧化铜的物质的量为:0.3mol×![]() =0.15mol,反应消耗的铜的物质的量为0.15mol,0.15mol铜完全反应失去0.3mol电子,根据电子守恒,O2得到的电子与铜失去的电子一定相等,则消耗氧气的物质的量为:n(O2)=0.3mol÷4=0.075mol,消耗标况下氧气的体积为:V(O2)=22.4L/mol×0.075mol=1.68L,B正确;
=0.15mol,反应消耗的铜的物质的量为0.15mol,0.15mol铜完全反应失去0.3mol电子,根据电子守恒,O2得到的电子与铜失去的电子一定相等,则消耗氧气的物质的量为:n(O2)=0.3mol÷4=0.075mol,消耗标况下氧气的体积为:V(O2)=22.4L/mol×0.075mol=1.68L,B正确;
C.设NO的物质的量为x、二氧化氮的物质的量为y,则x+y=0.2,根据电子守恒可得:3x+y=0.3,解得:x=0.05mol、y=0.15mol,所以混合气体中二氧化氮的体积为3.36L,C正确;
D.根据B的分析可知,反应转移的电子为0.3mol,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+2H2 (g)==N2 (g)+2H2O(g) 生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx( NO).cy( H2),k为速率常数。在800℃时测得的相关数据如下表所示。
实验数据 | 初始浓度 | 生成N2的初始速率/mol/(L·s) | |
c(NO)/mol/L | c(H2)/mol/L | ||
1 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
2 | 1.00×10-3 | 6.00×10-3 | 4.80×10-4 |
3 | 2.00×10-3 | 3.00×10-3 | 9.60×10-4 |
则下列说法中不正确的是( )
A. 当其他条件不变时,升高温度,速率常数将增大
B. 800℃时,k值为8×104
C. 若800℃时,初始浓度c(NO) =c( H2)=4.00×10-3 mol·L-l,则生成N2的初始速率为5. 12×10-3 mol/(L·s)
D. 关系式中x=l、y=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
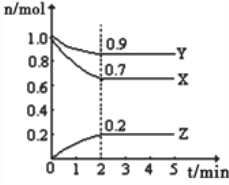
(1)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(2)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号)
2SO3(g)达到平衡状态的是_______(填序号)
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。(填序号)
2HI(g)达到平衡状态的是 _________。(填序号)
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应NO+CO2![]() CO+NO2在密闭容器中进行,下列哪些条件会使平衡发生移动:( )
CO+NO2在密闭容器中进行,下列哪些条件会使平衡发生移动:( )
A. 缩小体积使压强增大 B. 压强不变,充入N2使体积增大
C. 体积不变充入CO2使压强增大 D. 体积不变,充入H2使压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把0.2mol X气体和0.4mol Y气体混合于2L密闭容器中,使它们发生如下反应:![]() 末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol
末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol ![]() 。计算:
。计算:
①前2min内用Y 的浓度变化表示的反应速率为 ![]()
②化学方程式中n的值是 。
(2)在一定温度下,将4mol SO2与2mol O2放入4L的密闭容器中,在一定条件下反应,2SO2+O2![]() 2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
(3)某温度时在2L容器中A、B、C 三种气态物质的物质的量(n)随时间(l)变化的曲线如图所示,由图中数据分析:

①该反应的化学方程式为
②下列叙述能说明上述反应达到平衡状态的是 。
A、混合气体的总物质的量不随时间的变化而变化
B、相同时间内消耗2n mol 的A的同时生成4nmol 的C
C、混合气体的总质量不随时间的变化而变化
D、容器内压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组设计实验探究氮的化合物的性质,装置如图所示,其中A(装置未画出)为气体发生装置。检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:C处铂丝继续保持红热,F处铜片逐渐溶解。
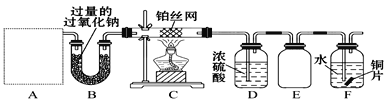
(1)若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_____(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
(2)装置B的作用是__________________________________。
(3)装置C中发生反应的化学方程式为_________________。
(4)该装置存在的主要缺陷是____________________。
(5)下图所示的E装置可防止F中溶液倒吸进入D中,请在图中画出装置E中的导气管_________________。

(6)若进入F装置的物质成分和质量一定,可向F中加入下列物质(填字母)中的___________使铜片溶解的质量增多。
A.Na2CO3 B.NaCl C.CuSO4 D.H2SO4
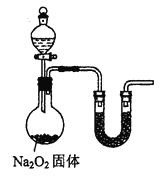
(7)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是______,U型管中加入试剂是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1)溴乙烷属于烷烃。(______)
(2)卤代烃属于有机化合物,都易燃烧。(______)
(3)卤代烃都可以发生水解反应和消去反应。(______)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com