
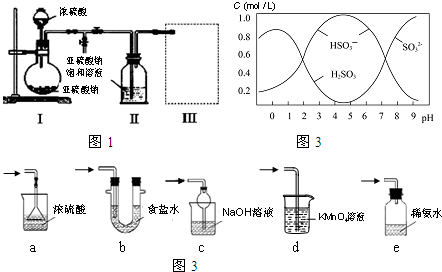
分析 (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作,根据过滤操作需要用到的玻璃仪器答题;装置Ⅲ用于处理尾气,吸收未反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
(4)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,据此书写水解方程式;当溶液pH小于1后,溶液中主要以亚硫酸形成存在,但亚硫酸不稳定,易分解生成二氧化硫,据此答题;
(5)用Na2S2O5做抗氧化剂,能被氧化成Na2SO4,根据电子得失守恒可知关系式Na2S2O5~O2,根据关系可计算出氧气的体积;
(6)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可;
解答 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作,过滤操作需要用到的玻璃仪器有玻璃棒、漏斗、烧杯,
a.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
d.高锰酸钾溶液能吸收二氧化硫,但该装置不能防倒吸,故错误
e.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误,故选c,
故答案为:玻璃棒、漏斗、烧杯;c;
(4)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,所以水解方程式为Na2S2O5+H2O=2NaHSO3,当溶液pH小于1后,溶液中主要以亚硫酸形成存在,但亚硫酸不稳定,易分解生成二氧化硫或亚硫酸被氧化也会导致浓度小,
故答案为:Na2S2O5+H2O=2NaHSO3;亚硫酸不稳定,易分解生成二氧化硫,或亚硫酸被氧化;
(5)1.90g Na2S2O5的物质的量为$\frac{1.90}{190}$mol=0.01mol,用Na2S2O5做抗氧化剂,能被氧化成Na2SO4,根据电子得失守恒可知关系式Na2S2O5~O2,所以能还原的氧气的物质的量为0.01mol,其体积为224mL,
故答案为:224;
(6)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加适量水溶解;滴加足量盐酸,振荡;再滴入氯化钡溶液,若有白色沉淀生成,则该晶体已被氧化,
故答案为:取少量Na2S2O5晶体于试管中,加适量水溶解;滴加足量盐酸,振荡;再滴入氯化钡溶液,若有白色沉淀生成,则该晶体已被氧化;
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径的大小:Na+>N3->H- | |
| B. | 它们与水发生的反应均属于氧化还原反应 | |
| C. | 两种化合物均只含离子键,不含共价键 | |
| D. | 两固体混合物溶于足量盐酸中可得到三种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.
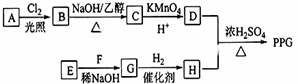
 (写结构简式)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有c(填标号).
(写结构简式)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有c(填标号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是光导纤维的主要成分 | B. | 氯气可用于自来水杀菌消毒 | ||
| C. | 氧化铁常用作红色油漆和涂料 | D. | 过氧化钠可用作潜艇里氧气的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
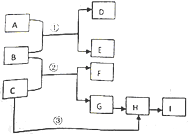 下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.
下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al元素最高化合价依次升高 | B. | P、S、Cl原子半径依次减小 | ||
| C. | N、O、F元素非金属性依次减弱 | D. | Li、Na、K原子的电子层数依次增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com