
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去):X![]() Y
Y![]() Z下列说法不正确的是( )
Z下列说法不正确的是( )
A. 若W是单质铁,则Z溶液可能是FeCl2溶液
B. 若W是氢氧化钠,则X与Z可反应生成Y
C. 若X是碳酸钠,则W可能是盐酸
D. 若W为氧气,则Z与水作用(或溶于水)一定生成一种强酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是 ( )
A. 向Al2(SO4)3溶液中加入过量氨水:Al3+ + 4NH3·H2O == AlO2- + 4NH4+ + 2H2O
B. 酸性溶液中KIO3与KI反应:I- + IO3- + 6H+ == I2 + 3H2O
C. 碳酸钠与次氯酸反应:CO32- + 2HClO = 2ClO- + H2O + CO2↑
D. 碘化亚铁溶液与少量氯气反应:2I- + Cl2 = I2 + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红蛋白(Hb)易与O2结合生成HbO2, CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。假设空气中氧气的体积分数为20%。据此,下列结论错误的是
O2+HbCO,平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。假设空气中氧气的体积分数为20%。据此,下列结论错误的是
A. 当HbCO的浓度达到HbO2浓度的0.02倍时,反应达到平衡
B. 可以把CO中毒的病人放入高压氧仓中解毒
C. 血红蛋白结合CO的能力强于O2
D. 空气中CO的体积分数不能超过1.8×10-5,否则对人体有害
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有①NO3- ②HCO3- ③SO32- ④CO32- ⑤SO42- 等五种阴离子,向其中加入少量的过氧化钠固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)( )
A. ① B. ①⑤ C. ①④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= +49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H= -192.9 kJ·mol-1
下列说法正确的是
A. CH3OH的燃烧热为192.9 kJ·mol-1
B. 反应①中的能量变化如图所示
C. CH3OH转变成H2的过程一定要吸收能量
D. 根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 该反应达到平衡后,保持容器休积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C. 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻v正<v逆
D. 830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1L恒容中,硫可以发生如下较化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
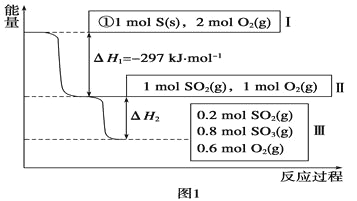
①写出能表示硫的燃烧热的热化学方程式:_________。,
②ΔH2=_________kJ·mol-1。
③在相同条件下,充入1molSO3和0.5mol的O2,则达到平衡时SO3的转化率为_______;此时该反应______(填“放出“或“吸收”)_______kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下40%~50%。
①CO2可转化成有机物实现碳循环。在休积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______mol/(L·min)
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。从3min到9min,v(H2)=_______mol/(L·min)
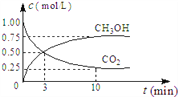
②为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有_______ (填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO2和H2合成。参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数。下列说法正确的是______________。
CH3OH(g)的平衡常数。下列说法正确的是______________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( )
A.Na+、SO42﹣、Cu2+、Cl﹣
B.Fe2+、Na+、OH﹣、K+
C.K+、CO32﹣、Cl﹣、Ag+
D.H+、Cl﹣、Na+、CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com