
| A. | 鸡蛋清溶于水所得澄清液体无丁达尔现象 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成CO2和H2O | |
| C. | 中国瓷器闻名世界,陶瓷的主要成分是SiO2 | |
| D. | 人体内的酶通常通过降低反应的活化能来加快对应反应速率 |
科目:高中化学 来源: 题型:解答题
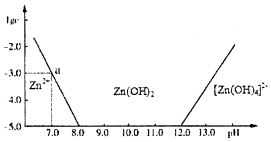 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
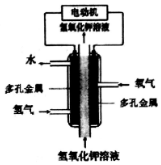
| A. | 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力 | |
| B. | 通H2的电极作负极,发生氧化反应 | |
| C. | 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O | |
| D. | 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
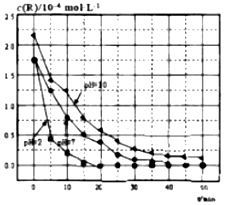
| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶于水中:CO32-+2H2O?H2CO3+2OH- | |
| B. | 硫酸氢铵与少量氢氧化钠溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氯化铝溶液中滴入过量浓氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 酸性高锰酸钾溶液与草酸溶液混合:5H2C2O4+6H++2MnO4-═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| B. | 32 g Cu和32 g S充分反应,转移的电子数为0.5NA | |
| C. | 1 mol Si中含有共价键数目为4NA | |
| D. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com