
分析 ①②③分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(3)令7.8g镁铝合金中Mg的物质的量为xmol,Al的物质的量为ymol,根据金属的质量、氢气的体积列方程,计算解答,依据消耗镁、铝的物质的量计算转移电子数;
解答 解:①浓硫酸溶解后未冷却至室温即转移至容量瓶中进行定容,冷却后溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
②定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2~3次,将洗涤液倒入烧杯中,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高;
故答案为:偏高;
(3)令7.8g镁铝合金中Mg的物质的量为xmol,Al的物质的量为ymol,则:24x+27y=7.8,
生成氢气的物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,根据电子转移守恒有:2x+3y=0.4×2,
联立方程,解得:x=0.1,y=0.2;
设转移电子数为n则:
2H+~H2↑~2e-
1 2
0.4mol n
解得n=0.8mol;
所以转移电子数为0.8NA;
依据镁、铝与盐酸反应生成气体关系得;
Mg~H2↑ Al~1.5H2↑
1 1 1 1.5
0.1mol 0.1mol 0.2mol 0.3mol
所以镁与铝与盐酸反应生成氢气的体积之比等于物质的量之比等于:0.1:0.3=1:3;
故答案为:0.8NA;1:3;
点评 本题考查了有关方程式的计算,明确发生反应的实质,熟悉以物质的量为核心的计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
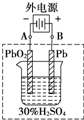 铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,请回答下列问题(不考虑氢、氧的氧化还原):
铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,请回答下列问题(不考虑氢、氧的氧化还原):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
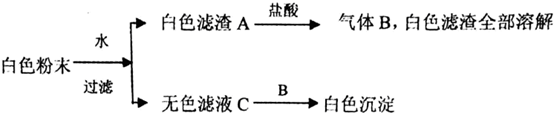
| A. | BaCl2,CaCO3一定存在,NaOH可能存在 | |
| B. | K2SO4、CuSO4一定不存在 | |
| C. | K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在 | |
| D. | C为单一溶质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤①③⑥ | B. | ⑤④②①③⑥ | C. | ⑤④②③①⑥ | D. | ②④⑤③①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2O | B. | C3H6O3 | C. | C3H8O3 | D. | C3H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com