
���� ��1�����ݹ�ʽN=nNA������ʵ�ԭ�ӹ��������㣻
��2���ȸ���һ����̼�Ͷ�����̼�ķ�����ɼ�������ߵ����ʵ���֮�ȣ���ͬ���������ʵ���֮�������֮�ȳ����ȣ�
��3���ٸ����������Ļ�ѧʽ��ɼ������������ӵ����ʵ�����������c=$\frac{n}{V}$�������������ӵ�Ũ�ȣ�
��4�����ݷ���ʽ��3CO+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2���м��㼴�ɣ�
��� �⣺��1��1.2g H2�����ʵ���Ϊ��$\frac{1.2g}{2g/mol}$=0.6mol�����е���ԭ�ӵ���ĿΪ��N��O��=0.6��2��NA=1.2NA��
�ʴ�Ϊ��1.2NA��
��2����״���£�������ͬ��ԭ������CO��CO2�����ʵ���֮��Ϊ��2��1�����֮��Ϊ��2��1��
�ʴ�Ϊ��2��1��
��3������Al2��SO4��3��֪����Һ�к��е���������ӵ����ʵ���Ϊ��n��SO42-��=$\frac{3}{2}$��0.2mol=0.3mol����Һ����������ӵ�Ũ��Ϊ��c��SO42-��=$\frac{0.3mol}{0.2L}$=1.5mol/L��
�ʴ�Ϊ��1.5mol/L��
��4����״����6.72L CO���ʵ�����$\frac{6.72L}{22.4L/mol}$=0.3mol�����ݷ���ʽ��3CO+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+3CO2���õ������������ʵ�����0.2mol��������0.2mol��56g/mol=11.2g���ʴ�Ϊ��11.2��
���� ���⿼�����ʵ����ļ��㣬�������������ʵ����Ĺ�ϵ�����ʵĹ��ɼ������Ļ�ѧ��ӦΪ���Ĺؼ���ע�ػ���֪ʶ�Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | 1molK����������3molH2�����ӳɷ�Ӧ | |
| B�� | �����������ᷴӦ | |
| C�� | �ʵ������£�1mol����������2mol Br2������Ӧ | |
| D�� | ҡͷ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ�У���Ӧ���������������������� | |
| B�� | ��ѧ��Ӧ�У���Ӧ���������������������� | |
| C�� | ��Һ�У�ϡ��ǰ����������ϡ�ͺ��������� | |
| D�� | �ڻ������У������ϼ������븺���ϼ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ƶĵ���ʽ��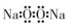 | B�� | ��������ӵĽṹʽ��H-Cl-O | ||
| C�� | C60��ʯī��Ϊͬλ�� | D�� | ����10�����ӵ���ԭ�ӣ�${\;}_{8}^{18}$O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
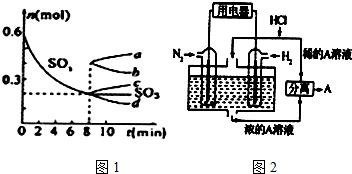
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ�ȣ�mol•L-1�� | 0.44 | 0.6 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1 mol NaHSO4������������������������Ϊ0.2 NA | |
| B�� | l L 0.1mol•L-1��H2SO3��Һ�к���H+����ĿΪ0.2 NA | |
| C�� | 7.8 g Na2O2�к��е���������ĿΪ0.1 NA | |
| D�� | ���³�ѹ�£�14 g��ϩ�ͱ�ϩ�Ļ����������ԭ����Ϊ 2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com