
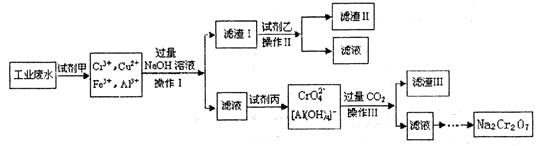
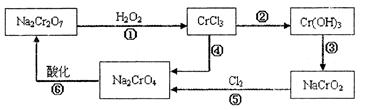
 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
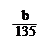 mol
mol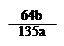 ×100℅
×100℅ 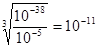 ,所以溶液的pH=3。
,所以溶液的pH=3。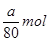 ,A正确。因为在调节溶液pH时,引入了铜离子,所以最终生成的氯化铜的物质的量大于粗氧化铜中氧化铜的物质的量,所以B正确,C不正确。调节溶液pH时,无法确定引入了多少铜离子,所以粗CuO中关于CuO的量无法确定,D正确,答案选ABD。
,A正确。因为在调节溶液pH时,引入了铜离子,所以最终生成的氯化铜的物质的量大于粗氧化铜中氧化铜的物质的量,所以B正确,C不正确。调节溶液pH时,无法确定引入了多少铜离子,所以粗CuO中关于CuO的量无法确定,D正确,答案选ABD。

科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫铁矿燃烧前需将矿粒粉碎,这样易于向沸腾炉中投料 |
| B.炉气进入接触室之前需要净化、干燥,因为炉气中的杂质易与SO2反应 |
| C.SO2氧化为SO3时需使用催化剂,这样可提高SO2的转化率 |
| D.接触室的反应温度控制在400~500 ℃,因为在该温度范围内催化剂的活性较高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯碱工业中若阳极产生0.1mol氯气则通过溶液的电子的物质的量为0.2mol |
| B.1L 1mol/LNa2CO3溶液中阴离子和阳离子的总数为3×6.02×1023 |
C.当碳酸溶液的PH增大1时,溶液中 可能增大也可能减小 可能增大也可能减小 |
| D.乙烯和苯分子中都存在碳碳双键,都能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石油的炼制过程都是化学变化过程 |
| B.石油分馏目的是将含碳原子数较多的烃先气化,后经冷凝而分离出来 |
| C.石油经石油分馏、催化裂化等工序炼制后即能制得纯净物 |
| D.石油分馏出来的各馏分仍是多种烃的混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使用太阳能等代替化石燃料,符合低碳节能减排的要求 |
| B.油脂在碱性条件下水解可制得肥皂 |
| C.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| D.二氧化硫的大量排放是造成光化学烟雾的主要原因 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
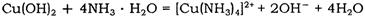
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com