
| 1 |
| 8 |
| 1 |
| 4 |


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:阅读理解


| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 还原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |
| ||
| 冰晶石 |
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
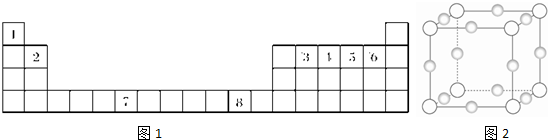
 下表为元素周期表的一部分,已经列出①-⑩10种元素在周期表中的位置.请用化学符号回答下列问题:
下表为元素周期表的一部分,已经列出①-⑩10种元素在周期表中的位置.请用化学符号回答下列问题:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | ⅦA | 0 | |
| 第2周期 | ⑦ | |||||||
| 第3周期 | ① | ③ | ⑤ | ⑥ | ⑧ | ⑩ | ||
| 第4周期 | ② | ④ | ⑨ |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
I | II | III | IV | V | VI | VII | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源:上海市吴淞中学2011届高三上学期第二次月考化学试题 题型:022
下表是由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处.请用相应的化学用语回答下列问题:
(1)e元素原子结构示意图为________;e与g可以形成1∶1型化合物,该化合物电子式为________,它属于________化合物(填“离子”、“共价”).
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式________.
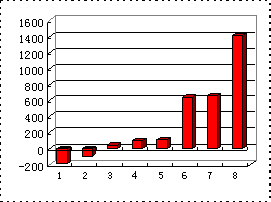
(3)下图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表________(填化学式),判断理由是________.
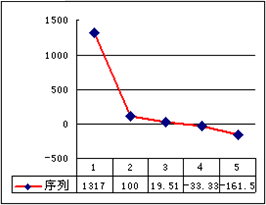
(4)b、c、d、e、f所对应的最简单氢化物的沸点(℃)直角坐标图(下图),序列“5”的氢化物的名称是________,已知c元素最简单的氢化物8 g在空气中完全燃烧生成液态水时,放出445.15 kJ热量,该反应的热化学方程式为:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com