
常温下,0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。请回答下列问题:
(1)混合后溶液的pH=8的原因是(用离子方程式表示):____________。
(2)混合溶液中由水电离出的c(H+)__________(填“<”、“>”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)。
(3)已知NH4A溶液为中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为________(填序号)。
a.NH4HCO3 b.NH4A
c.(NH4)2CO3 d.NH4Cl
答案 (1)A-+H2OHA+OH- (2)>
(3)> c>a>b>d
解析 (1)0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合得到0.05 mol·L-1 NaA溶液,混合溶液的pH=8,说明NaA为强碱弱酸盐,A-水解使溶液呈碱性。(2)混合溶液中由水电离出的c(H+)=10-6 mol·L-1,而0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)=10-13 mol·L-1。(3)HA溶液加入Na2CO3溶液中有气体放出,说明HA的酸性比碳酸强,由于NH4A溶液显中性,则(NH4)2CO3溶液显碱性。由于酸性:HCl>HA>H2CO3>HCO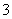 ,故四种盐溶液的pH大小为c>a>b>d。
,故四种盐溶液的pH大小为c>a>b>d。


科目:高中化学 来源: 题型:
在一定条件下,可逆反应N2(g)+3H2(g)
 2NH3(g) ΔH<0,达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) ΔH<0,达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆都发生变化且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
C.降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
D.加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质能使品红溶液褪色,且褪色原理基本相同的组合是( )
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④ B.②③⑤
C.②④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液的酸碱性和pH:
(1)25 ℃,0.01 mol·L-1的盐酸中,c(OH-)=________ mol·L-1,pH=____________,由水电离出的c(H+)=________。
(2)100 ℃时,pH=6的水中c(H+)=________ mol·L-1,该水显________性。
(3)100 ℃时(Kw=10-12),0.01 mol·L-1的NaOH溶液的pH为________________,由水电离出的c(OH-)=________。
(4)25 ℃时,pH=8的CH3COONa溶液中c(OH-)=__________________,由水电离的c(OH-)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,对pH=3的醋酸溶液(Ⅰ)和pH=11的氢氧化钠溶液(Ⅱ),下列说法正确的是( )
A.Ⅰ和Ⅱ的物质的量浓度均为0.001 mol·L-1
B.将Ⅰ稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小
C.Ⅰ和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量
D.Ⅰ和Ⅱ等体积混合后,溶液中离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ba2+有很强的毒性,医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是______________________(用沉淀溶解平衡原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是(双选)( )
A.MnS的Ksp比CuS的Ksp小
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=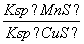
查看答案和解析>>
科目:高中化学 来源: 题型:

某活动小组测定制取的Na2S2O3·5H2O的纯度的方法如下:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O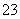 +I2===S4O
+I2===S4O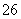 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是(双选)( )
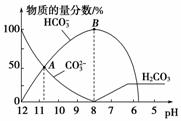
A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=2c(CO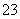 )+c(HCO
)+c(HCO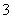 )+c(OH-)
)+c(OH-)
B.当溶液的pH为7时,溶液的总体积为20 mL
C.在B点所示的溶液中,浓度最大的阳离子是Na+
D.在A点所示的溶液中:c(CO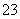 )=c(HCO
)=c(HCO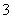 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com